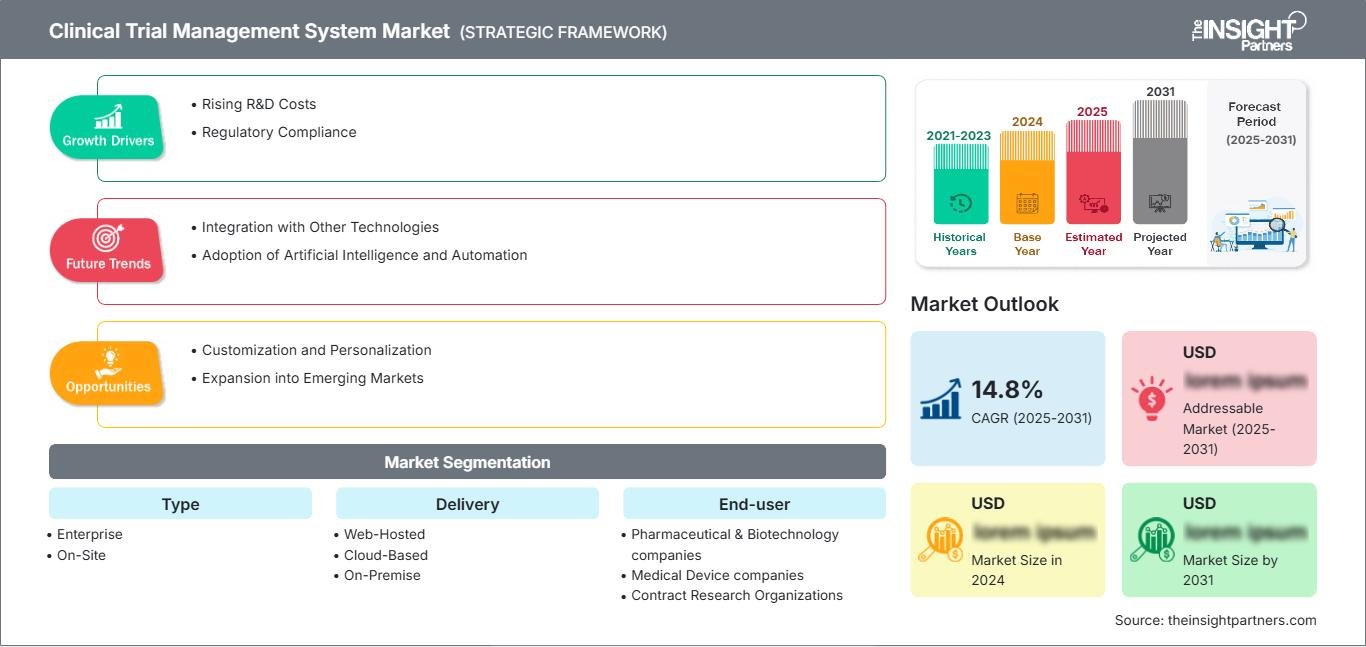
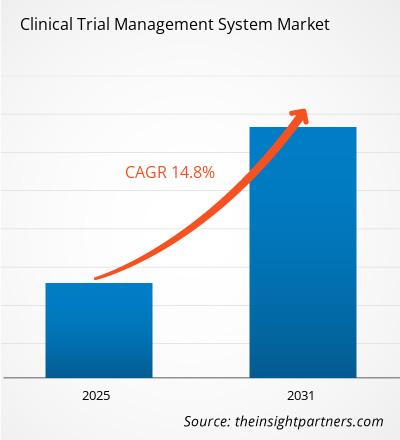
Le marché des systèmes de gestion des essais cliniques devrait enregistrer un TCAC de 14,8 % entre 2025 et 2031, avec une taille de marché passant de XX millions de dollars américains en 2024 à XX millions de dollars américains d'ici 2031.
Le rapport est segmenté par type (entreprise et sur site) ; livraison (hébergée sur le Web, dans le cloud et sur site) ; utilisateur final (sociétés pharmaceutiques et biotechnologiques, sociétés de dispositifs médicaux, organismes de recherche sous contrat [CRO] et autres). L'analyse mondiale est ensuite ventilée au niveau régional et par principaux pays. Le rapport présente la valeur en USD pour l'analyse et les segments ci-dessus.
Objectif du rapport
Le rapport sur le marché des systèmes de gestion des essais cliniques de The Insight Partners vise à décrire le paysage actuel et la croissance future, les principaux facteurs moteurs, les défis et les opportunités. Cela fournira des informations à diverses parties prenantes commerciales, telles que :
- Fournisseurs/fabricants de technologie : pour comprendre l’évolution de la dynamique du marché et connaître les opportunités de croissance potentielles, leur permettant de prendre des décisions stratégiques éclairées.
- Investisseurs : pour effectuer une analyse complète des tendances concernant le taux de croissance du marché, les projections financières du marché et les opportunités qui existent tout au long de la chaîne de valeur.
- Organismes de réglementation : pour réglementer les politiques et surveiller les activités du marché dans le but de minimiser les abus, de préserver la confiance des investisseurs et de maintenir l’intégrité et la stabilité du marché.
Segmentation du marché des systèmes de gestion des essais cliniques : Type
- Entreprise
- Sur site
Livraison
- Hébergé sur le Web
- Dans le cloud
- Sur site
Utilisateur final
- Entreprises pharmaceutiques et biotechnologiques
- Entreprises de dispositifs médicaux
- Organismes de recherche sous contrat
Géographie
- Amérique du Nord
- Europe
- Asie-Pacifique
- Moyen-Orient et Afrique
- Amérique du Sud et centrale
Vous bénéficierez d’une personnalisation sur n’importe quel rapport - gratuitement - y compris des parties de ce rapport, ou une analyse au niveau du pays, un pack de données Excel, ainsi que de profiter d’offres exceptionnelles et de réductions pour les start-ups et les universités
Marché des systèmes de gestion des essais cliniques: Perspectives stratégiques
-
Obtenez les principales tendances clés du marché de ce rapport.Cet échantillon GRATUIT comprendra une analyse de données, allant des tendances du marché aux estimations et prévisions.
Moteurs de croissance du marché des systèmes de gestion des essais cliniques
- Augmentation des coûts de R&D : Les investissements dans les activités de recherche et développement pour les essais cliniques augmentent. Ce facteur conduit à l’adoption de solutions numériques qui gèrent efficacement les processus d’essais cliniques. De plus, l’augmentation des coûts de recherche et développement encourage les organisations à adopter des systèmes avancés de gestion des essais cliniques.
- Conformité réglementaire : La surveillance réglementaire croissante et la nécessité de se conformer aux directives de bonnes pratiques cliniques (BPC) nécessitent l’adoption de systèmes robustes pour le suivi et la documentation des essais.
Tendances futures du marché des systèmes de gestion des essais cliniques
- Intégration avec d’autres technologies : L’intégration des systèmes de gestion des essais cliniques avec des technologies telles que la saisie électronique des données (SED), les dossiers médicaux électroniques (DME) et d’autres systèmes cliniques sera renforcée afin de créer un flux de travail fluide. Les technologies d’intégration pour de meilleurs résultats entraîneront la croissance du marché dans les années à venir.
- Adoption de l'intelligence artificielle et de l'automatisation : L'adoption de l'IA et des algorithmes d'apprentissage automatique améliorera la gestion des données, le recrutement des patients et l'analyse. Ce facteur rend le système de gestion des essais cliniques plus efficace et efficient.
Opportunités de marché des systèmes de gestion des essais cliniques
- Personnalisation : Proposer des solutions personnalisables adaptées aux besoins spécifiques de certains secteurs, comme l'oncologie ou les maladies rares, peut donner aux prestataires un avantage concurrentiel. Pour obtenir un avantage concurrentiel, les acteurs du marché peuvent adopter un système de gestion des essais cliniques.
- Expansion sur les marchés émergents : Alors que les systèmes de santé des pays en développement adoptent massivement les solutions numériques, il existe des opportunités de croissance du marché, car il peut fournir des services d'essais cliniques améliorés à ses utilisateurs finaux.
Aperçu régional du marché des systèmes de gestion des essais cliniques
Les tendances régionales et les facteurs influençant le marché des systèmes de gestion des essais cliniques tout au long de la période de prévision ont été analysés en détail par les analystes de The Insight Partners. Cette section aborde également les segments de marché et la géographie des systèmes de gestion des essais cliniques en Amérique du Nord, en Europe, en Asie-Pacifique, au Moyen-Orient et en Afrique, ainsi qu'en Amérique du Sud et en Amérique centrale.
Portée du rapport sur le marché des systèmes de gestion des essais cliniques
| Attribut de rapport | Détails |
|---|---|
| Taille du marché en 2024 | US$ XX million |
| Taille du marché par 2031 | US$ XX Million |
| TCAC mondial (2025 - 2031) | 14.8% |
| Données historiques | 2021-2023 |
| Période de prévision | 2025-2031 |
| Segments couverts |
By Type
|
| Régions et pays couverts |
Amérique du Nord
|
| Leaders du marché et profils d'entreprises clés |
|
Densité des acteurs du marché des systèmes de gestion des essais cliniques : comprendre son impact sur la dynamique commerciale
Le marché des systèmes de gestion des essais cliniques connaît une croissance rapide, portée par une demande croissante des utilisateurs finaux, due à des facteurs tels que l'évolution des préférences des consommateurs, les avancées technologiques et une meilleure connaissance des avantages du produit. Face à cette demande croissante, les entreprises élargissent leur offre, innovent pour répondre aux besoins des consommateurs et capitalisent sur les nouvelles tendances, ce qui alimente la croissance du marché.
- Obtenez le Marché des systèmes de gestion des essais cliniques Aperçu des principaux acteurs clés
- Analyse historique (2 ans), année de base, prévision (7 ans) avec TCAC
- Analyse PEST et SWOT
- Taille du marché Valeur / Volume - Mondial, Régional, Pays
- Industrie et paysage concurrentiel
- Ensemble de données Excel
Rapports récents
Rapports connexes
Témoignages
Raison d'acheter
- Prise de décision éclairée
- Compréhension de la dynamique du marché
- Analyse concurrentielle
- Connaissances clients
- Prévisions de marché
- Atténuation des risques
- Planification stratégique
- Justification des investissements
- Identification des marchés émergents
- Amélioration des stratégies marketing
- Amélioration de l'efficacité opérationnelle
- Alignement sur les tendances réglementaires





















 Obtenez un échantillon gratuit pour - Marché des systèmes de gestion des essais cliniques
Obtenez un échantillon gratuit pour - Marché des systèmes de gestion des essais cliniques