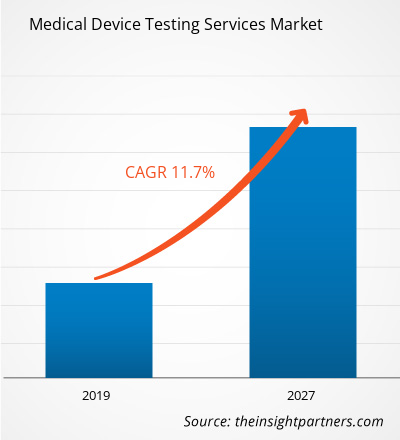
Der Markt für Prüfdienstleistungen für Medizinprodukte im Gesundheitswesen hatte im Jahr 2018 einen Wert von 5.505,4 Millionen US-Dollar und soll bis 2027 14.660,1 Millionen US-Dollar erreichen; von 2019 bis 2027 wird mit einer durchschnittlichen jährlichen Wachstumsrate von 11,7 % gerechnet.
Medizinprodukte sind von entscheidender Bedeutung, da sie einen direkten Einfluss auf das Leben der Patienten haben. Um den Patienten ein qualitativ hochwertiges und sicheres Erlebnis zu bieten, testen die Hersteller von Medizinprodukten diese, bevor sie sie auf den Markt bringen. Hersteller von Medizinprodukten führen die Tests vorzugsweise intern durch oder lagern die Testdienstleistungen an Auftragsforschungsinstitute (CROs) aus, um die strengen gesetzlichen Richtlinien einzuhalten. Die Prüfung der Medizinprodukte soll die Sicherheit, Qualität und Konsistenz der Dienste während aller Phasen der Entwicklung und Verwendung des Medizinprodukts sicherstellen. Die medizinische Behandlung ist in hohem Maße von Medizinprodukten abhängig, daher ist es wichtig sicherzustellen, dass die Prüfung der Medizinprodukte mit äußerster Kompetenz durchgeführt wird. Das Wachstum des Marktes für Medizinprodukte-Testdienstleistungen im Gesundheitswesen ist auf innovative Produktentwicklungen, Kooperationen, Fusionen und Übernahmen zurückzuführen. Strenge regulatorische Rahmenbedingungen für die Zulassung von Medizinprodukten fördern das Marktwachstum im Laufe der Jahre. Darüber hinaus dürften sich die Entwicklungen in der Medizinproduktebranche im Prognosezeitraum positiv auf die Nachfrage auswirken. Das Marktwachstum wird jedoch durch Faktoren wie Unterbrechungen vertraglicher Verpflichtungen gebremst.
Der Markt für Prüfdienste für Medizinprodukte im Gesundheitswesen dürfte nach der Pandemie ein erhebliches Wachstum verzeichnen. SGS SA, Eurofins, Toxikon, Pace Analytical Services, LLC, Intertek Group plc, NORTH AMERICAN SCIENCE ASSOCIATES INC., Charles River, WuXi AppTec, Element Materials Technology, TÜV SÜD AG Es wird erwartet, dass mRNA aufkommt und die Pharmaindustrie verändert, und es wird erwartet, dass der Markt in den kommenden Jahren auch mehr vertikale Integration und Joint Ventures erleben wird.
Markteinblicke: Zunehmende Anwendungen von Prüfdiensten für Medizinprodukte im Gesundheitswesen treiben das Wachstum des Marktes für Prüfdienste für Medizinprodukte im Gesundheitswesen voran
Passen Sie diesen Bericht Ihren Anforderungen an
Sie erhalten kostenlos Anpassungen an jedem Bericht, einschließlich Teilen dieses Berichts oder einer Analyse auf Länderebene, eines Excel-Datenpakets sowie tolle Angebote und Rabatte für Start-ups und Universitäten.
Markt für Testdienste für medizinische Geräte: Strategische Einblicke

-
Holen Sie sich die wichtigsten Markttrends aus diesem Bericht.Dieses KOSTENLOSE Beispiel umfasst Datenanalysen, die von Markttrends bis hin zu Schätzungen und Prognosen reichen.
Das Testen von Medizinprodukten erfordert umfassende Fachkenntnisse, Kenntnisse der nationalen Gesetzgebung sowie Kenntnisse über die Geräte, die Infrastruktur und die Fähigkeit, die Tests durchzuführen. Die Gesundheits- und Medizinproduktebranche ist aufgrund kontinuierlicher Entwicklung und fortschrittlicher Lösungen sehr aktiv. Die Fortschritte in der Medizinproduktetechnologie haben die Effizienz der Patientenversorgung in den letzten Jahrzehnten deutlich verbessert.
Hersteller verschiedener Medizinprodukte stehen jedoch manchmal vor der Herausforderung, ihre Produkte marktreif zu machen. Die Vorschriften sind mitunter komplex und schwer verständlich, vor allem wenn es um die Anwendung innovativer und neuartiger Medizinprodukte geht.
Ein Rückruf ist ein Prozess zur Entfernung oder Änderung von Produkten, die nicht den Gesetzen der Food and Drug Administration (FDA) entsprechen. Rückrufe von Medizinprodukten werden von den Unternehmen meist freiwillig gemäß 21 CFR 7 durchgeführt. Die Produktrückrufe werden von der FDA in verschiedene Kategorien wie I, II oder III eingeteilt, um das jeweilige Gesundheitsrisiko des zurückgerufenen Produkts anzugeben.
Laut der FDA aus dem Jahr 2018 wurden seit 2008 über 80.000 Vorfälle aufgrund von Verletzungen durch Medizinprodukte festgestellt. In den letzten Jahren haben Medizinproduktehersteller und Ärzte festgestellt, dass Rückenmarksstimulatoren Patienten mit Schmerzstörungen helfen. Dadurch sind sie zu einem der wachstumsstärksten Produkte in der 400 Milliarden Dollar schweren Medizinproduktebranche geworden. Die zunehmenden Produktrückrufe und die höhere Nachfrage nach Qualitätsprodukten lassen den Bedarf an Tests für Medizinprodukte steigen. Dies wird den Markt für Testdienstleistungen für Medizinprodukte ankurbeln.
Medizinproduktetechnologie verbessert das Leben, indem sie Krankheiten frühzeitig erkennt und Behandlung, Diagnose und Patientenüberwachung verbessert. Schulungsprogramme für kleine und mittlere Unternehmen (KMU) wurden in Ländern wie China, Chile, Indonesien, Mexiko, Malaysia, Singapur, den Philippinen, Peru, Russland und Vietnam umgesetzt. Im Jahr 2018 wurde der Markt für Medizinprodukte in Großbritannien auf rund 10,6 Milliarden US-Dollar geschätzt. Darunter sind rund 2.500 kleine bis mittelgroße Medizintechnikunternehmen in Großbritannien. Außerdem hat eine große Zahl multinationaler Unternehmen ihren Hauptsitz oder ihre Tochtergesellschaften im Land. Darüber hinaus geben die Akutversorgungsunternehmen jedes Jahr durchschnittlich rund 6,6 Milliarden US-Dollar für klinische Bedarfsartikel aus, zu denen auch medizinische Geräte gehören.
Darüber hinaus erwähnte die International Trade Administration (ITA) im Jahr 2018, dass es in Frankreich über 1.300 Medizintechnikunternehmen gibt, von denen ein Drittel ausländische Unternehmen sind. Diese ausländischen Medizintechnikunternehmen machen jedoch etwa zwei Drittel des Gesamtgeschäfts aus.
Darüber hinaus sind etwa 92 % der 1.300 Medizintechnikunternehmen in Frankreich kleine und mittelgroße Unternehmen (KMU), von denen 88 % ausschließlich Medizinprodukte herstellen. KMU lagern die Prüfung von Medizinprodukten aus, da dies teuer, zeitaufwändig und mit Fachkräften verbunden ist.
Darüber hinaus entfallen mehr als 80 Prozent des Medizinprodukteumsatzes auf Madrid und Katalonien. Davon entfallen 90 % des Medizinproduktemarktes auf kleine und mittlere Unternehmen, die rund 40 % des Gesamtumsatzes mit Medizinprodukten erwirtschaften. Da es sich bei diesen Unternehmen um Start-ups handelt, entscheiden sie sich für das Outsourcing der Medizinprodukteprüfung, um Kosten zu senken und Zeit zu sparen. Daher wird der wachsende Bedarf in der Branche voraussichtlich das Wachstum des globalen Marktes für Medizinprodukteprüfungsdienste in den kommenden Jahren vorantreiben. Die Bereitstellung fortschrittlicher Medizinproduktetechnologie für die Verbraucher ist ein risikoreiches Projekt. Daher bieten die Unternehmen korrekte Tests an, indem sie genaue und zuverlässige Ergebnisse für die Prüfanforderungen für Medizinprodukte liefern – vom kleinen Start-up bis zum großen, etablierten Hersteller.
Viele Labore in Nordamerika, Europa und im asiatisch-pazifischen Raum bieten Wissen zur Einhaltung gesetzlicher Vorschriften und qualifizierte GMP-/GLP-/ISO 17025-Prüfungen, um schnelle Verbesserungszeiten durch ein Höchstmaß an Service und modernste Technologien für die mikrobiologischen, analytisch-chemischen, Biokompatibilitäts- und Verpackungsprüfanforderungen zu gewährleisten.
In anderen Ländern gibt es verschiedene Regulierungsbehörden, die sich mit der Regulierung von Medizinprodukten befassen. In Spanien werden Medizinprodukte von der spanischen Agentur für Arzneimittel und Gesundheitsprodukte (AEMPS) kontrolliert und zugelassen. Der Food and Drugs Act (FDA) legt den regulatorischen Rahmen für zahlreiche Medizinprodukte fest. Das Medical Devices Bureau ist eine weitere Behörde, die für die Richtlinien für Medizinprodukte zuständig ist, die den Verkauf und Import von Medizinprodukten ermöglichen.
Für alle Medizinprodukte gelten exklusive und systematische Testanforderungen der FDA, der China Food and Drug Administration (CFDA), benannter Stellen der EU und anderer Regulierungsbehörden, die vor der Markteinführung befolgt werden sollten.
In Kanada hat Health Canada die Meldepflicht für Vorfälle mit Medizinprodukten durch Importeure und Hersteller eingeführt und ermutigt auch medizinisches Fachpersonal, Krankenhäuser und Verbraucher/Patienten zur Meldung. In Mexiko ist COFEPRIS für die Zulassung und Registrierung von Medizinprodukten zuständig. Der Hersteller muss alle Testanforderungen erfüllen und die COFEPRIS-Zulassung beantragen.
Die Medicines and Healthcare products Regulatory Agency (MHRA) ist die zuständige Behörde für die Medizinproduktegesetze im Vereinigten Königreich. Sie prüft Medizinprodukte mit potenziellen Problemen und gewährleistet deren Sicherheit und Qualität. In Japan arbeiten das japanische Ministerium für Gesundheit, Arbeit und Soziales (MHLW) und die Pharmaceuticals and Medical Devices Agency (PMDA) zusammen, um wissenschaftliche Tests von Medizinprodukten für die Markteinführung durchzuführen und deren Sicherheit nach der Markteinführung zu überwachen.
Daher wird erwartet, dass die zunehmend strengeren Vorschriften für innovative und präzise Geräte das Wachstum des Marktes für Prüfdienstleistungen für Medizinprodukte im Prognosezeitraum vorantreiben.
Servicebasierte Einblicke
In Bezug auf die Dienstleistungen sind die Prüfdienstleistungen für Medizinprodukte im Gesundheitswesen in Biokompatibilitätstests, chemische Tests, Mikrobiologie- und Sterilitätstests sowie Verpackungsvalidierung unterteilt. Im Jahr 2018 waren es im Bereich Mikrobiologie und Sterilitätstests hatten mit 53,55 % den größten Marktanteil am Markt für Prüfdienstleistungen für medizinische Geräte, nach Dienstleistung.
Prüfdienstleistungen für medizinische Geräte
Regionale Einblicke in den Markt für Prüfdienste für medizinische GeräteDie Analysten von The Insight Partners haben die regionalen Trends und Faktoren, die den Markt für Medizinprodukte-Testservices im Prognosezeitraum beeinflussen, ausführlich erläutert. In diesem Abschnitt werden auch die Marktsegmente und die geografische Lage in Nordamerika, Europa, dem asiatisch-pazifischen Raum, dem Nahen Osten und Afrika sowie Süd- und Mittelamerika erörtert.
Umfang des Marktberichts zu Prüfdienstleistungen für medizinische Geräte
| Berichtsattribut | Einzelheiten |
|---|---|
| Marktgröße in 2018 | US$ 5.51 Billion |
| Marktgröße nach 2027 | US$ 14.66 Billion |
| Globale CAGR (2018 - 2027) | 11.7% |
| Historische Daten | 2016-2017 |
| Prognosezeitraum | 2019-2027 |
| Abgedeckte Segmente |
By Service
|
| Abgedeckte Regionen und Länder |
Nordamerika
|
| Marktführer und wichtige Unternehmensprofile |
|
Dichte der Marktteilnehmer für Prüfdienste für medizinische Geräte: Verständnis ihrer Auswirkungen auf die Geschäftsdynamik
Der Markt für Prüfdienstleistungen für Medizinprodukte wächst rasant. Dies wird durch die steigende Nachfrage der Endnutzer aufgrund veränderter Verbraucherpräferenzen, technologischer Fortschritte und eines stärkeren Bewusstseins für die Produktvorteile vorangetrieben. Mit der steigenden Nachfrage erweitern Unternehmen ihr Angebot, entwickeln Innovationen, um den Bedürfnissen der Verbraucher gerecht zu werden, und nutzen neue Trends, was das Marktwachstum weiter ankurbelt.
- Holen Sie sich die Markt für Testdienste für medizinische Geräte Übersicht der wichtigsten Akteure
Basierend auf den Phasen ist der Markt für Prüfdienstleistungen für Medizinprodukte im Gesundheitswesen in präklinische und klinische Bereiche unterteilt. Im Jahr 2018 hielt das präklinische Segment einen beträchtlichen Marktanteil von 68,17 % am Markt für Prüfdienstleistungen für Medizinprodukte nach Phasen.
Die Akteure des Marktes für Prüfdienstleistungen für Medizinprodukte im Gesundheitswesen verfolgen Strategien zur Produkteinführung und -erweiterung, um den sich weltweit ändernden Kundenanforderungen gerecht zu werden und so ihren Markennamen weltweit zu behaupten.
Prüfdienstleistungen für Medizinprodukte im Gesundheitswesen – nach Dienstleistung
- Biokompatibilitätstest
- Chemietest
- Mikrobiologie- und Sterilitätstests
- Verpackungsvalidierung
Prüfdienstleistungen für Medizinprodukte im Gesundheitswesen – nach Phase
- Präklinisch
- Klinisch
Testdienste für Medizinprodukte im Gesundheitsmarkt – nach Geografie
-
Nordamerika
- USA
- Kanada
- Mexiko
-
Europa
- Frankreich
- Deutschland
- Italien
- Großbritannien
- Spanien
- Restliches Europa
-
Asien-Pazifik (APAC)
- China
- Indien
- Südkorea
- Japan
- Australien
- Restlicher APAC
-
Naher Osten und Afrika (MEA)
- Südafrika
- Saudi-Arabien
- VAE
- Rest von MEA
-
Südamerika und Mittelamerika (SCAM)
- Brasilien
- Argentinien
- Rest von SCAM
Unternehmen Profile
- SGS SA
- Eurofins
- Toxikon
- Pace Analytical Services, LLCAG
- Historische Analyse (2 Jahre), Basisjahr, Prognose (7 Jahre) mit CAGR
- PEST- und SWOT-Analyse
- Marktgröße Wert/Volumen – Global, Regional, Land
- Branchen- und Wettbewerbslandschaft
- Excel-Datensatz
Aktuelle Berichte
Verwandte Berichte
Erfahrungsberichte
Grund zum Kauf
- Fundierte Entscheidungsfindung
- Marktdynamik verstehen
- Wettbewerbsanalyse
- Kundeneinblicke
- Marktprognosen
- Risikominimierung
- Strategische Planung
- Investitionsbegründung
- Identifizierung neuer Märkte
- Verbesserung von Marketingstrategien
- Steigerung der Betriebseffizienz
- Anpassung an regulatorische Trends





















 Kostenlose Probe anfordern für - Markt für Testdienste für medizinische Geräte
Kostenlose Probe anfordern für - Markt für Testdienste für medizinische Geräte