Le marché européen des logiciels de surveillance des dispositifs médicaux devrait atteindre 280,23 millions USD d'ici 2031, contre 143,9 millions USD en 2023. Le marché devrait enregistrer un TCAC de 8,7 % au cours de la période 2023-2031. Les logiciels en tant que dispositifs médicaux devraient apporter un nouvel ensemble de tendances clés sur le marché dans les années à venir.
Analyse du marché européen des logiciels de surveillance des dispositifs médicaux
L'augmentation de la conformité réglementaire, l'essor de la technologie médicale et la complexité croissante des dispositifs médicaux stimulent le marché européen des logiciels de vigilance des dispositifs médicaux . L'objectif principal d'un système de vigilance des dispositifs médicaux est d'améliorer la protection de la santé et de la sécurité des patients, des professionnels de la santé et du public en minimisant la probabilité de récurrence d'incidents indésirables impliquant des dispositifs médicaux. Cet objectif est atteint grâce à divers mécanismes. La vigilance des dispositifs médicaux implique la collecte, l'évaluation, la compréhension et la réponse aux nouvelles informations sur les risques associés à l'utilisation des dispositifs médicaux. Ces risques sont notamment les incidents indésirables, les interactions avec d'autres substances ou dispositifs, les contre-indications, la contrefaçon, les dysfonctionnements et les défauts techniques.
Aperçu du marché européen des logiciels de surveillance des dispositifs médicaux
L'objectif principal d'un logiciel de surveillance des dispositifs médicaux est de soutenir la surveillance post-commercialisation des dispositifs médicaux, en garantissant leur sécurité et leur efficacité continues tout au long de leur cycle de vie. La surveillance post-commercialisation est essentielle pour garantir qu'aucun événement indésirable ou autre problème ne se produise avec un produit. Les risques liés à des effets imprévus liés à une utilisation à long terme sont identifiés et traités dès que possible. L'objectif de la surveillance post-commercialisation est de garantir que les produits restent sûrs et efficaces tout en surveillant en permanence leurs avantages et leurs risques.
Les fonctionnalités du logiciel de vigilance des dispositifs médicaux comprennent les rapports d'incidents concernant les dysfonctionnements, la collecte de toutes les données pertinentes conformément aux rapports sur les dispositifs médicaux, l'attribution de numéros de rapport spéciaux du fabricant et le respect de toutes les exigences en matière de paperasse et de tenue de dossiers ; le stockage des données d'incident, l'analyse de l'attribution des dispositifs et l'évaluation et l'enquête sur les rapports pour récupérer rapidement et facilement les données ; et la création de nombreux rapports à soumettre à divers organismes de réglementation dans toute la région.
Personnalisez la recherche en fonction de vos besoins
Nous pouvons optimiser et adapter l'analyse et la portée de vos projets, ce qui n'est pas possible avec nos offres standards. Cette flexibilité vous aidera à obtenir les informations exactes nécessaires à la planification et à la prise de décision de votre entreprise.
Marché européen des logiciels de surveillance des dispositifs médicaux : informations stratégiques
-
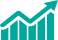
TCAC (2023 - 2031)8,7% -
Taille du marché 2023
143,9 millions USD -
Taille du marché 2031
280,23 millions USD

Dynamique du marché
- « Exigences réglementaires strictes liées aux dispositifs médicaux
- L'essor de la technologie médicale
- « Complexité accrue des dispositifs médicaux »
- Le logiciel comme dispositif médical
- La transformation numérique dans le secteur de la santé
- Croissance du marché des dispositifs médicaux
Acteurs clés
- Oracle Corp
- AB Cube SAS
- Sarjen Systems Pvt Ltd
- AssurX Inc
- UL Solutions Inc
- Honeywell International Inc
- PTC Inc
- Intel Corp
- Application maximale
- Xybion Digital Inc
Aperçu régional
- Europe
Segmentation du marché
 Application
Application
- Diagnostique
- Thérapeutique
- Chirurgical
- Recherche
 Mode de déploiement
Mode de déploiement
- Nuage
- Sur site
 Utilisation finale verticale
Utilisation finale verticale
- Organismes de recherche clinique
- Externalisation des processus d'entreprise
- Fabricants d'équipement d'origine
- L'exemple PDF présente la structure du contenu et la nature des informations avec une analyse qualitative et quantitative.
Moteurs et opportunités du marché européen des logiciels de surveillance des dispositifs médicaux
Complexité accrue des dispositifs médicaux
Les logiciels de dispositifs médicaux sont un élément essentiel des systèmes de santé modernes. Les solutions logicielles du marché des dispositifs médicaux sont nécessaires pour gérer les interfaces utilisateur, les données des patients, les réglementations et la complexité des produits. Leur adoption réduit les risques lors du développement des dispositifs médicaux et de leurs logiciels et contribue à accélérer le développement et le déploiement des logiciels. Il supervise également la gestion des risques dans le secteur de la santé. À mesure que le marché des dispositifs médicaux se développe, le défi de l'équilibre entre le matériel, les logiciels et la réglementation augmente. Les outils de gestion des exigences et les logiciels de vigilance des dispositifs médicaux sont étroitement liés dans le secteur de la santé en ce qui concerne le développement des dispositifs médicaux et la gestion de leur cycle de vie. Ainsi, pour gérer la complexité des dispositifs médicaux, la demande de logiciels de vigilance des dispositifs médicaux augmente.
Les progrès des technologies médicales ont permis d'améliorer les diagnostics et les traitements, de réaliser des diagnostics plus précoces et plus précis, de proposer des traitements plus efficaces et de garantir la sécurité des patients. Les dispositifs médicaux évoluent rapidement avec l'intégration du système numérique, des conceptions de dispositifs médicaux modernes et compactes et la dépendance au système logiciel. Cela génère une complexité en termes de surveillance, de reporting et de garantie de la sécurité des dispositifs médicaux. En outre, le respect de normes réglementaires plus strictes encourage les fabricants de dispositifs médicaux à adopter des solutions logicielles avancées capables de relever les défis liés à la complexité accrue des dispositifs médicaux.
La transformation numérique dans le secteur de la santé
Le secteur européen de la santé numérique favorise l'utilisation de diverses technologies numériques qui améliorent les établissements de santé. L'utilisation des technologies numériques pour l'information et la communication afin de gérer les maladies, d'éviter les risques pour la santé et de promouvoir la sécurité des patients favorise la numérisation du secteur de la santé en Europe. Les autorités européennes s'efforcent en permanence de fournir des services améliorés aux citoyens. Pour cela, elles sont continuellement engagées dans des activités d'investissement. Par exemple, le programme EU4Health a été adopté avec un budget de plus de 5,9 milliards de dollars américains (5,3 milliards d'euros) au cours de la période 2021-2027 pour construire des systèmes de santé plus solides, plus résilients et plus accessibles. Cet investissement favorise la numérisation du système de santé et l'accès aux médicaments, aux dispositifs médicaux et aux produits pertinents en cas de crise. La majorité des nouveaux projets étant déjà en cours depuis décembre 2023, l'objectif des subventions est d'aider les pays de l'UE à mettre en œuvre le futur espace européen des données de santé (EHDS). Un tel investissement peut promouvoir l'innovation, le développement et l'adoption de logiciels de vigilance des dispositifs médicaux qui répondent aux normes réglementaires et améliorent la sécurité des patients. L’adoption de logiciels de vigilance peut améliorer la résilience des systèmes de santé lors de crises sanitaires telles que la COVID-19. Ils peuvent fournir des rapports plus rapides et analyser les données sur les performances des dispositifs médicaux. En cas d’urgence, ils peuvent accélérer la prise de décision et la gestion des risques. Ainsi, la numérisation du système de santé en Europe entraîne des avancées significatives dans tous les aspects des soins de santé, ce qui permet au secteur d’obtenir de meilleurs résultats de santé de manière plus efficace. Ce facteur permet l’adoption de solutions visant à minimiser les risques pour la qualité et à accélérer la mise sur le marché et la conformité réglementaire, ce qui favorise encore davantage la demande de logiciels de vigilance des dispositifs médicaux en Europe.
Analyse de segmentation du rapport sur le marché européen des logiciels de surveillance des dispositifs médicaux
Les segments clés qui ont contribué à l’élaboration de l’analyse du marché européen des logiciels de vigilance des dispositifs médicaux sont l’application, le mode de déploiement et l’utilisation finale verticale.
- En fonction des applications, le marché est divisé en diagnostic, thérapeutique, chirurgical, recherche et autres. Le segment du diagnostic détenait la plus grande part de marché des logiciels de vigilance des dispositifs médicaux en Europe en 2023.
- En fonction du mode de déploiement, le marché est divisé en cloud et sur site. Le segment cloud détenait une part de marché plus importante des logiciels de vigilance des dispositifs médicaux en Europe en 2023.
- En fonction de l'utilisation finale, le marché est divisé en CRO, BPO, OEM et autres. Le segment des fabricants d'équipements d'origine (OEM) détenait la plus grande part de marché européenne des logiciels de vigilance des dispositifs médicaux en 2023.
Analyse des parts de marché des logiciels de surveillance des dispositifs médicaux en Europe par zone géographique
Le marché européen des logiciels de surveillance des dispositifs médicaux est segmenté en Allemagne, en France, au Royaume-Uni, en Russie, en Espagne et dans le reste de l'Europe. L'Allemagne a dominé le marché en 2023, suivie de la France et du Royaume-Uni.
Les incidents indésirables impliquant des dispositifs médicaux au Royaume-Uni doivent être signalés à la Medicines and Healthcare Products Regulatory Agency (MHRA). La MHRA supervise le marché britannique des dispositifs médicaux. Une fois qu'un dispositif médical est mis sur le marché britannique, le fabricant est tenu de soumettre des rapports de vigilance à la MHRA chaque fois que certains types d'incidents impliquant son dispositif se produisent au Royaume-Uni. Le fabricant doit également prendre les mesures de sécurité appropriées si nécessaire. Le fabricant doit s'assurer que son dispositif répond aux normes de sécurité et de performance applicables pendant toute la durée de son utilisation. Le fabricant de dispositifs médicaux, la personne responsable au Royaume-Uni ou le représentant autorisé basé en Irlande du Nord doit signaler à la MHRA les incidents concernant les dispositifs médicaux et les rapports de vigilance post-commercialisation. De tels mandats pour le rapport et la surveillance du système de vigilance entraînent la demande de logiciels de vigilance des dispositifs médicaux pour un reporting efficace et une surveillance post-commercialisation.
Portée du rapport sur le marché européen des logiciels de surveillance des dispositifs médicaux
| Attribut de rapport | Détails |
|---|---|
| Taille du marché en 2023 | 143,9 millions de dollars américains |
| Taille du marché d'ici 2031 | 280,23 millions de dollars américains |
| Taux de croissance annuel composé mondial (2023-2031) | 8,7% |
| Données historiques | 2021-2022 |
| Période de prévision | 2024-2031 |
| Segments couverts |
Par application
|
| Régions et pays couverts |
Europe
|
| Leaders du marché et profils d'entreprises clés |
|
- L'exemple PDF présente la structure du contenu et la nature des informations avec une analyse qualitative et quantitative.
Actualités et développements récents du marché européen des logiciels de surveillance des dispositifs médicaux
Le marché européen des logiciels de vigilance des dispositifs médicaux est évalué en collectant des données qualitatives et quantitatives issues de recherches primaires et secondaires, qui comprennent d'importantes publications d'entreprise, des données d'association et des bases de données. Quelques-uns des développements du marché européen des logiciels de vigilance des dispositifs médicaux sont répertoriés ci-dessous :
- Oracle a annoncé de nouvelles fonctionnalités dans ses solutions Oracle Argus et Safety One Intake, basées sur l'IA, pour aider les organisations du secteur des sciences de la vie à répondre aux exigences réglementaires en constante évolution et au volume croissant de charges de travail liées aux événements indésirables. Grâce à de nouvelles améliorations conçues pour augmenter la productivité, améliorer la confidentialité des données et améliorer les rapports, les utilisateurs peuvent répondre plus efficacement aux réglementations et exigences dynamiques propres à chaque pays et accélérer la fiabilité et la transparence de la gestion des dossiers de sécurité, des essais cliniques à la surveillance post-commercialisation. (Source : Oracle Corporation, communiqué de presse, juillet 2024)
- Ab Cube Company a dévoilé quatre nouvelles applications de vigilance de nouvelle génération d'IA dans l'AB Cube Galaxy. Ces nouveaux modules offrent de puissantes améliorations à la suite SafetyEasy de base pour des opérations de multivigilance rapides, efficaces et évolutives. Le nouveau module piloté par l'IA de la société applique une technologie avancée de traitement du langage naturel (NLP), permettant aux clients de copier et coller le verbatim de leur ICSR, qui est ensuite automatiquement converti en un cas dans la suite SafetyEasy, réduisant ainsi l'effort de prise en charge des cas de 70 %. (Source : Ab Cube Company, communiqué de presse, juin 2024)
Rapport sur le marché européen des logiciels de surveillance des dispositifs médicaux
Le rapport « Europe Medical Device Vigilance Software Market Size and Forecast (2021-2031) » fournit une analyse détaillée du marché couvrant les domaines mentionnés ci-dessous :
- Taille et prévisions du marché européen des logiciels de vigilance des dispositifs médicaux aux niveaux régional et national pour tous les segments de marché clés couverts par le périmètre
- Tendances du marché européen des logiciels de vigilance des dispositifs médicaux , ainsi que la dynamique du marché, comme les facteurs moteurs, les contraintes et les opportunités clés
- Analyse PEST et SWOT détaillée
- Analyse du marché européen des logiciels de vigilance des dispositifs médicaux couvrant les principales tendances du marché, le cadre régional, les principaux acteurs, les réglementations et les développements récents du marché
- Analyse du paysage industriel et de la concurrence couvrant la concentration du marché, l'analyse de la carte thermique, les principaux acteurs et les développements récents du marché européen des logiciels de vigilance des dispositifs médicaux
- Profils d'entreprise détaillés
- Analyse historique (2 ans), année de base, prévision (7 ans) avec TCAC
- Analyse PEST et SWOT
- Taille du marché Valeur / Volume - Mondial, Régional, Pays
- Industrie et paysage concurrentiel
- Ensemble de données Excel
Rapports récents
Témoignages
Raison d'acheter
- Prise de décision éclairée
- Compréhension de la dynamique du marché
- Analyse concurrentielle
- Connaissances clients
- Prévisions de marché
- Atténuation des risques
- Planification stratégique
- Justification des investissements
- Identification des marchés émergents
- Amélioration des stratégies marketing
- Amélioration de l'efficacité opérationnelle
- Alignement sur les tendances réglementaires





















 Obtenez un échantillon gratuit pour - Marché européen des logiciels de surveillance des dispositifs médicaux
Obtenez un échantillon gratuit pour - Marché européen des logiciels de surveillance des dispositifs médicaux