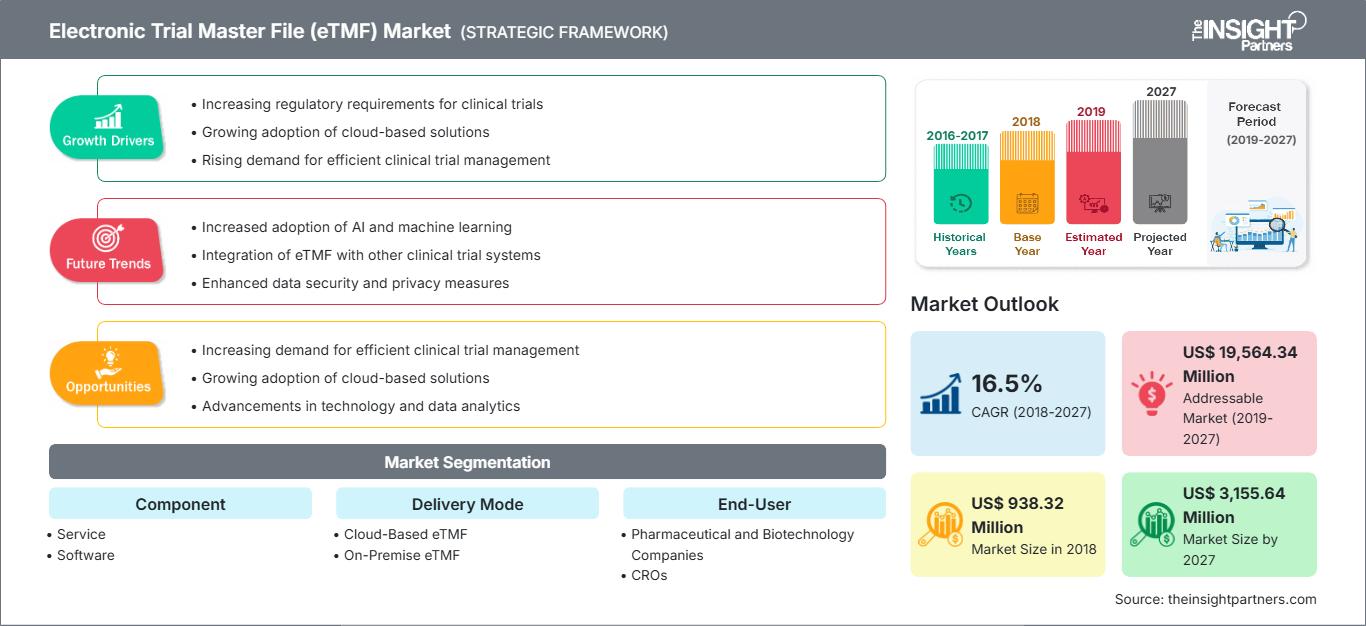
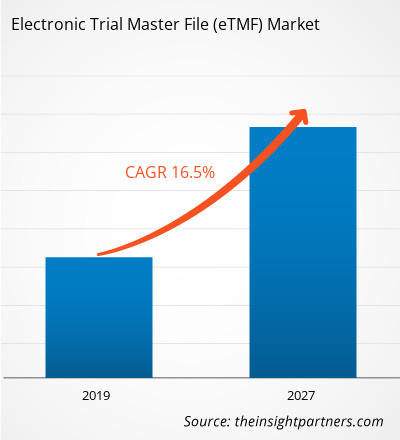
[Rapporto di ricerca]Il mercato dell'Electronic Trial Master File nel settore sanitario è stato valutato a 938,32 milioni di dollari nel 2018 e si prevede che raggiungerà i 3.155,64 milioni di dollari entro il 2027; si prevede una crescita a un CAGR del 16,5% dal 2019 al 2027.
I sistemi Electronic Trial Master File (eTMF) possono essere definiti come un'integrazione di componenti software e hardware collettivamente responsabili della gestione ottimale dei dati degli studi clinici. Queste soluzioni contribuiscono a semplificare i dati generati nel corso di uno studio clinico in un formato digitale facile da archiviare, che può essere recuperato da utenti diversi, con vantaggi in termini di facile accessibilità e riduzione dei costi associati alle operazioni amministrative e di manutenzione manuale dei dati negli studi clinici. La crescita del Trial Master File Elettronico nel mercato sanitario è attribuita all'aumento del numero di sperimentazioni cliniche, alla crescente prevalenza di malattie e al progresso tecnologico che hanno stimolato il mercato nel corso degli anni. Tuttavia, la carenza di professionisti qualificati avrà probabilmente un impatto negativo sulla crescita del mercato nei prossimi anni. D'altro canto, l'aumento delle iniziative strategiche da parte degli operatori del mercato offrirà probabilmente opportunità di crescita nei prossimi anni.
Si prevede che il mercato del Trial Master File Elettronico nel mercato sanitario registrerà una crescita sostanziale dopo la pandemia. Il COVID-19 ha colpito economie e settori in diversi paesi a causa di lockdown, divieti di viaggio e chiusure aziendali. La crisi del COVID-19 ha sovraccaricato i sistemi sanitari pubblici in molti paesi e ha evidenziato la forte necessità di investimenti sostenibili nei sistemi sanitari. Con il progredire della pandemia di COVID-19, si prevede che il settore sanitario registrerà un calo della crescita. Il segmento delle scienze della vita prospera grazie alla crescente domanda di prodotti diagnostici in vitro e all'aumento delle attività di ricerca e sviluppo in tutto il mondo. Tuttavia, il segmento delle tecnologie mediche e dell'imaging sta assistendo a un calo delle vendite a causa del minor numero di interventi chirurgici eseguiti e del ritardo o del prolungamento dell'approvvigionamento delle attrezzature. Inoltre, si prevede che le consulenze virtuali da parte degli operatori sanitari diventeranno il modello di erogazione dell'assistenza sanitaria più diffuso dopo la pandemia. Con la telemedicina che sta trasformando l'erogazione dell'assistenza, la salute digitale continuerà a prosperare nei prossimi anni. Inoltre, l'interruzione degli studi clinici e il conseguente ritardo nel lancio dei farmaci dovrebbero aprire la strada a studi clinici completamente virtuali in futuro. Si prevede che nuove tecnologie come l'mRNA emergeranno e trasformeranno l'industria farmaceutica e si prevede che il mercato assisterà a una maggiore integrazione verticale e joint venture nei prossimi anni.
Personalizza questo rapporto in base alle tue esigenze
Potrai personalizzare gratuitamente qualsiasi rapporto, comprese parti di questo rapporto, o analisi a livello di paese, pacchetto dati Excel, oltre a usufruire di grandi offerte e sconti per start-up e università
Mercato del file master di prova elettronico (eTMF): Approfondimenti strategici
-
Ottieni le principali tendenze chiave del mercato di questo rapporto.Questo campione GRATUITO includerà l'analisi dei dati, che vanno dalle tendenze di mercato alle stime e alle previsioni.
La ricerca e sviluppo (R&S) è una parte significativa ed essenziale del business di un'azienda. Le attività dell'industria farmaceutica hanno un impatto socioeconomico significativo sulla società, sotto forma di investimenti in R&S e produzione. La ricerca e sviluppo è la "spina dorsale" di qualsiasi sistema di scoperta di farmaci per il successo, e il Trial Master File Elettronico è un software essenziale nella ricerca e sviluppo di nuove entità terapeutiche basate su farmaci e biotecnologie. Le aziende farmaceutiche e biotecnologiche si concentrano principalmente sulla ricerca e sviluppo (R&S) per ideare nuove molecole per varie applicazioni terapeutiche con il più significativo potenziale medico e commerciale. Le aziende investono in modo significativo in R&S con l'obiettivo di fornire al mercato prodotti innovativi e di alta qualità. Ad esempio, la spesa globale in ricerca e sviluppo nel 2017 è aumentata del 3,9%, raggiungendo i 165 miliardi di dollari rispetto al 2016. La spesa media in ricerca e sviluppo è aumentata moderatamente, attestandosi al 20,9% in percentuale sulle vendite totali di farmaci da prescrizione. Inoltre, secondo un sondaggio annuale condotto tra i membri della PhRMA, nel 2017 le aziende farmaceutiche hanno dichiarato di aver speso 71,4 miliardi di dollari in ricerca e sviluppo.
Le aziende farmaceutiche hanno investito di più in ricerca e sviluppo per potenziare il processo di sperimentazione clinica. Ad esempio, al 30 giugno 2019, AstraZeneca ha aperto la strada spendendo il 25,63% dei ricavi in ricerca e sviluppo; al 31 marzo 2019, Holding Strong, Eli Lilly and Company ha speso il 22,38% dei suoi ricavi in R&S; e, al 30 giugno 2019, Roche Holding AG non era molto indietro con il 21,29% speso in R&S.
Le spese per ricerca e sviluppo vengono solitamente sostenute durante i processi di scoperta, test e sviluppo di nuovi prodotti, pagamenti anticipati e milestone, miglioramento dei risultati esistenti, nonché dimostrazione dell'efficacia del prodotto e della conformità normativa prima del lancio. Inoltre, gli investimenti in R&S da parte delle aziende farmaceutiche negli Stati Uniti sono cresciuti costantemente negli ultimi 15 anni.
Lo sviluppo e la scoperta di farmaci sono un processo lungo e costoso. Il processo che va dalla diagnosi precoce o dalla progettazione allo sviluppo fino all'approvazione normativa può richiedere più di 10-15 anni. Durante la fase di sviluppo di un principio attivo, sono necessari diversi servizi di test per verificarne la qualità e l'efficacia. Pertanto, le aziende farmaceutiche e biotecnologiche preferiscono salvare i dati in un master file elettronico per risparmiare costi e tempi, il che dovrebbe favorire la crescita del mercato.
Gli studi clinici rappresentano uno dei passaggi più importanti e significativi nella scoperta di un farmaco, indipendentemente dal fatto che il trattamento, la strategia medica o il dispositivo siano sicuri ed efficaci sia per uso umano che veterinario. Gli studi clinici aiutano a comprendere e determinare i migliori approcci terapeutici per determinati ambiti terapeutici. Gli studi clinici vengono condotti specificamente per raccogliere dati sulla sicurezza e l'efficacia dello sviluppo di un nuovo prodotto e strumento. Prima che le autorità di regolamentazione approvino le molecole del farmaco e i dispositivi medici, vengono condotti una serie di studi clinici. La crescente prevalenza di varie malattie trasmissibili e non trasmissibili sta aumentando la domanda di sviluppo di nuovi farmaci o dispositivi medici per il trattamento. Ciò, a sua volta, dovrebbe aumentare la domanda di attività di sperimentazione clinica per diverse aree terapeutiche.
Le aziende biofarmaceutiche e farmaceutiche coinvolte nelle sperimentazioni cliniche mirano a passare dai sistemi di gestione documentale cartacei in archivi a sistemi di gestione documentale elettronica, in cui i documenti vengono archiviati in archivi elettronici online. Implementando un sistema eTMF completo che consenta alle organizzazioni di automatizzare, acquisire e gestire documenti e registrazioni TMF, si evitano rischi inutili e si possono spesso ottenere risparmi sui costi delle sperimentazioni cliniche rispetto ai processi di gestione manuale della carta.
Un aumento dell'adozione di un sistema di archiviazione elettronica dei trial nel processo clinico probabilmente darà impulso al mercato. Ad esempio, NextDocs di Aurea Software è un forum di archiviazione elettronica dei trial (eTMF) per la cooperazione clinica nella gestione delle cartelle cliniche. Si tratta di un sistema di gestione dei contenuti per l'industria farmaceutica che offre un mezzo formalizzato per organizzare e archiviare documenti, fotografie e altri contenuti digitali per le sperimentazioni cliniche farmaceutiche che potrebbero essere richiesti per conformarsi alle normative delle agenzie governative di regolamentazione. Nelle sperimentazioni cliniche, l'EMA supporta pienamente l'uso di sistemi eTMF per l'archiviazione elettronica in sostituzione della carta. L'agenzia cita problemi di qualità con TMF ed eTMF in una dichiarazione cautelativa, dovuti al contenuto cartaceo e a incongruenze come pagine mancanti, etichettatura inadeguata o documenti incompleti. Grazie alle caratteristiche innovative di eTMF, come la centralizzazione e la gestione della documentazione degli studi clinici, le potenti funzionalità di ricerca (con metadati) e i molteplici metodi di aggiunta di documenti, eTMF sta diventando importante per l'efficienza aziendale, il risparmio sui costi e la riduzione dei tempi di produzione di prodotti biofarmaceutici, per l'implementazione di processi di gestione elettronica dei documenti. Il segreto per l'introduzione di framework eTMF interoperabili è l'utilizzo di un modello di contenuto comune, standard basati su vocabolario e tecnologie di standardizzazione basate sul web.
Grazie al progresso del trial master file verso il trial master file elettronico, le organizzazioni di ricerca a contratto e le aziende farmaceutiche e biotecnologiche stanno adottando eTMF per una migliore gestione dei dati clinici e dei processi di gestione degli studi clinici. Le ragioni e i fattori sopra menzionati contribuiscono alla crescita del mercato dei file master di sperimentazione elettronici.
Approfondimenti basati sui componenti
In termini di componenti, il mercato dei file master di sperimentazione elettronici nel settore sanitario è segmentato in servizi e software. Il segmento dei servizi ha detenuto la quota maggiore del mercato nel 2019.
Approfondimenti basati sulla modalità di distribuzione
In base alla modalità di distribuzione, il mercato dei file master di sperimentazione elettronici nel settore sanitario è segmentato in eTMF basati su cloud ed eTMF on-premise. Il segmento eTMF basato su cloud ha detenuto la quota maggiore del mercato nel 2019.
Approfondimenti basati sull'utente finale
In termini di utente finale, il mercato dei file master di sperimentazione elettronici nel settore sanitario è segmentato in aziende farmaceutiche e biotecnologiche, società di consulenza e altri. Il segmento delle aziende farmaceutiche e biotecnologiche ha detenuto la quota maggiore del mercato nel 2019.
Gli operatori del mercato sanitario stanno adottando strategie di lancio ed espansione dei prodotti per soddisfare le mutevoli esigenze dei clienti in tutto il mondo, il che consente loro anche di mantenere il proprio marchio a livello globale.
Mercato del file master di prova elettronico (eTMF)
Le tendenze regionali e i fattori che influenzano il mercato dell'Electronic Trial Master File (eTMF) durante il periodo di previsione sono stati ampiamente spiegati dagli analisti di The Insight Partners. Questa sezione illustra anche i segmenti e la geografia del mercato dell'Electronic Trial Master File (eTMF) in Nord America, Europa, Asia-Pacifico, Medio Oriente e Africa, America Meridionale e Centrale.
Ambito del rapporto di mercato sui file master di prova elettronici (eTMF)
| Attributo del rapporto | Dettagli |
|---|---|
| Dimensioni del mercato in 2018 | US$ 938.32 Million |
| Dimensioni del mercato per 2027 | US$ 3,155.64 Million |
| CAGR globale (2018 - 2027) | 16.5% |
| Dati storici | 2016-2017 |
| Periodo di previsione | 2019-2027 |
| Segmenti coperti |
By Componente
|
| Regioni e paesi coperti |
Nord America
|
| Leader di mercato e profili aziendali chiave |
|
Densità degli operatori del mercato dell'Electronic Trial Master File (eTMF): comprendere il suo impatto sulle dinamiche aziendali
Il mercato dei file elettronici di prova (eTMF) è in rapida crescita, trainato dalla crescente domanda degli utenti finali, dovuta a fattori quali l'evoluzione delle preferenze dei consumatori, i progressi tecnologici e una maggiore consapevolezza dei vantaggi del prodotto. Con l'aumento della domanda, le aziende stanno ampliando la propria offerta, innovando per soddisfare le esigenze dei consumatori e sfruttando le tendenze emergenti, alimentando ulteriormente la crescita del mercato.
- Ottieni il Mercato del file master di prova elettronico (eTMF) Panoramica dei principali attori chiave
Fascicolo master elettronico di sperimentazione nel mercato sanitario - per componente
- Servizio
- Software
Fascicolo master elettronico di sperimentazione nel mercato sanitario - per modalità di consegna
- eTMF basato su cloud
- eTMF on-premise
Fascicolo master elettronico di sperimentazione nel mercato sanitario - per utente finale
- Aziende farmaceutiche e biotecnologiche
- CRO
- Altri
Fascicolo master elettronico di sperimentazione nel mercato sanitario - per utente finale per area geografica
-
America del Nord
- Stati Uniti
- Canada
- Messico
-
Europa
- Francia
- Germania
- Italia
- Regno Unito
- Spagna
- Resto di Europa
-
Asia Pacifico (APAC)
- Cina
- India
- Corea del Sud
- Giappone
- Australia
- Resto dell'APAC
-
Medio Oriente e Asia. Africa (MEA)
- Sudafrica
- Arabia Saudita
- Emirati Arabi Uniti
- Resto del MEA
-
America del Sud e America Centrale (SCAM)
- Brasile
- Argentina
- Resto di SCAM
Azienda Profili
- Aurea, Inc.
- Transperfect.
- Covance Inc (Lab Corp)
- Oracle
- Ennov
- Mastercontrol, Inc.
- Omnicomm
- Pharmavigilalnce
- Veeva Systems
- Phlexglobal
- Analisi storica (2 anni), anno base, previsione (7 anni) con CAGR
- Analisi PEST e SWOT
- Valore/volume delle dimensioni del mercato - Globale, Regionale, Nazionale
- Industria e panorama competitivo
- Set di dati Excel
Report recenti
Testimonianze
Motivo dell'acquisto
- Processo decisionale informato
- Comprensione delle dinamiche di mercato
- Analisi competitiva
- Analisi dei clienti
- Previsioni di mercato
- Mitigazione del rischio
- Pianificazione strategica
- Giustificazione degli investimenti
- Identificazione dei mercati emergenti
- Miglioramento delle strategie di marketing
- Aumento dell'efficienza operativa
- Allineamento alle tendenze normative





















 Ottieni un campione gratuito per - Mercato del file master di prova elettronico (eTMF)
Ottieni un campione gratuito per - Mercato del file master di prova elettronico (eTMF)