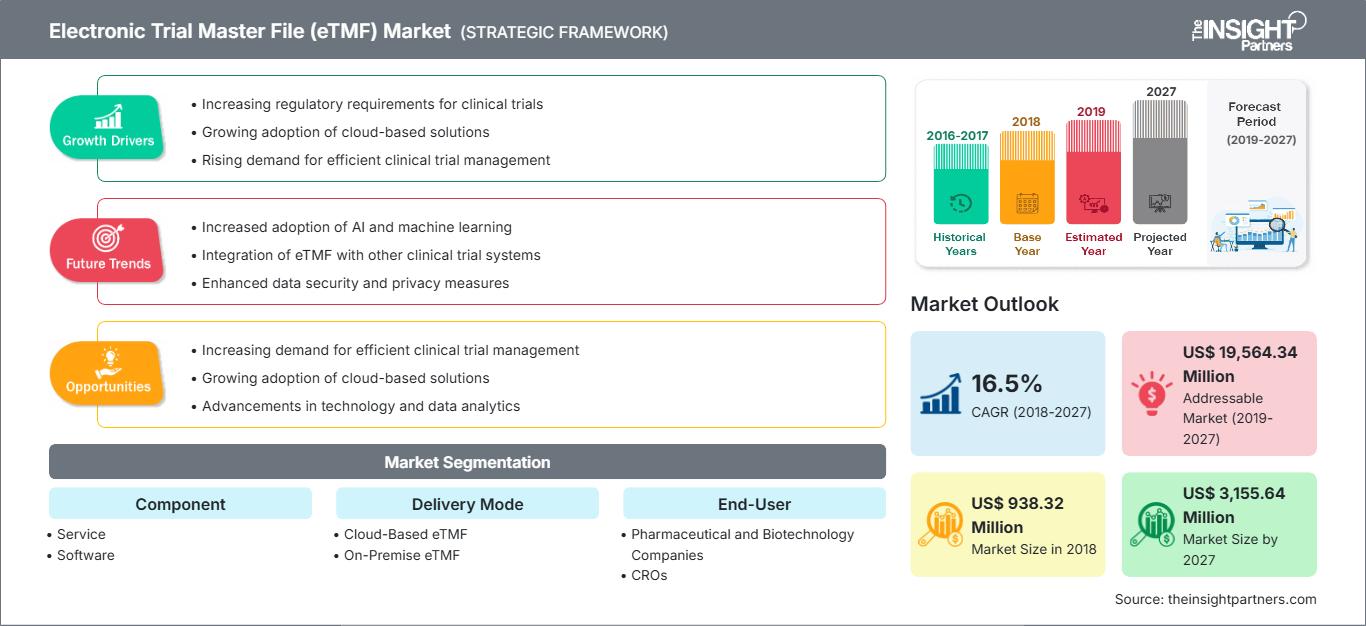
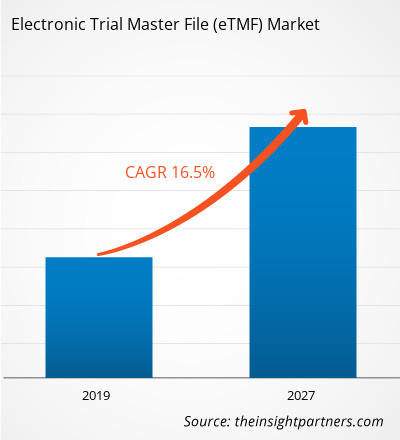
[Forschungsbericht] Der Wert des elektronischen Trial Master Files im Gesundheitsmarkt wurde 2018 auf 938,32 Millionen US-Dollar geschätzt und soll bis 2027 3.155,64 Millionen US-Dollar erreichen; von 2019 bis 2027 wird ein CAGR-Wachstum von 16,5 % erwartet.
Electronic Trial Master File (eTMF)-Systeme können als Integration von Software- und Hardwarekomponenten definiert werden, die gemeinsam für die optimale Verwaltung klinischer Studiendaten verantwortlich sind. Diese Lösungen helfen dabei, die im Verlauf einer klinischen Studie generierten Daten in einem leicht zu speichernden digitalen Format zu rationalisieren, das von unterschiedlichen Benutzern abgerufen werden kann, was von einfacher Zugänglichkeit profitiert und die mit der administrativen und manuellen Datenpflege verbundenen Kosten bei klinischen Studien senkt. Das Wachstum des elektronischen Trial Master Files im Gesundheitsmarkt ist auf die steigende Anzahl klinischer Studien, die zunehmende Prävalenz von Krankheiten und den technologischen Fortschritt zurückzuführen, die dem Markt im Laufe der Jahre Auftrieb gegeben haben. Der Fachkräftemangel dürfte sich jedoch in den kommenden Jahren negativ auf das Marktwachstum auswirken. Andererseits dürften zunehmende strategische Initiativen der Marktteilnehmer in den kommenden Jahren Wachstumschancen bieten.
Der Markt für elektronische Studienstammdaten im Gesundheitswesen dürfte nach der Pandemie ein erhebliches Wachstum verzeichnen. COVID-19 hat die Volkswirtschaften und Branchen in verschiedenen Ländern durch Lockdowns, Reiseverbote und Geschäftsschließungen beeinträchtigt. Die COVID-19-Krise hat die öffentlichen Gesundheitssysteme in vielen Ländern überlastet und den dringenden Bedarf an nachhaltigen Investitionen in die Gesundheitssysteme verdeutlicht. Mit Fortschreiten der COVID-19-Pandemie wird für die Gesundheitsbranche ein Wachstumsrückgang erwartet. Der Bereich Life Sciences floriert aufgrund der gestiegenen Nachfrage nach In-vitro-Diagnostika und der weltweit zunehmenden Forschungs- und Entwicklungsaktivitäten. Der Bereich Medizintechnik und Bildgebung verzeichnet jedoch Umsatzrückgänge aufgrund geringerer Operationen und verzögerter oder längerer Gerätebeschaffung. Darüber hinaus wird erwartet, dass virtuelle Konsultationen durch medizinisches Fachpersonal nach der Pandemie zum gängigen Versorgungsmodell werden. Da die Telemedizin die Gesundheitsversorgung verändert, wird die digitale Gesundheit in den kommenden Jahren weiter florieren. Darüber hinaus wird erwartet, dass unterbrochene klinische Studien und die daraus resultierende Verzögerung bei der Markteinführung von Medikamenten den Weg für künftige vollständig virtuelle Studien ebnen. Neue Technologien wie mRNA werden voraussichtlich aufkommen und die Pharmaindustrie verändern. Zudem wird der Markt in den kommenden Jahren voraussichtlich mehr vertikale Integration und Joint Ventures erleben.
Passen Sie diesen Bericht Ihren Anforderungen an
Sie erhalten kostenlos Anpassungen an jedem Bericht, einschließlich Teilen dieses Berichts oder einer Analyse auf Länderebene, eines Excel-Datenpakets sowie tolle Angebote und Rabatte für Start-ups und Universitäten.
Markt für elektronische Trial Master File (eTMF): Strategische Einblicke
-
Holen Sie sich die wichtigsten Markttrends aus diesem Bericht.Dieses KOSTENLOSE Beispiel umfasst Datenanalysen, die von Markttrends bis hin zu Schätzungen und Prognosen reichen.
Forschung und Entwicklung (F&E) ist ein bedeutender und wesentlicher Teil des Geschäfts eines Unternehmens. Die Aktivitäten der Pharmaindustrie haben in Form von Investitionen in F&E und Produktion erhebliche sozioökonomische Auswirkungen auf die Gesellschaft. Forschung und Entwicklung sind das „Rückgrat“ jedes erfolgreichen Arzneimittelentdeckungssystems und die elektronische Studienstammdatei ist eine wesentliche Software in der Forschung und Entwicklung neuer pharmazeutischer und biotechnologischer Therapieeinheiten. Pharma- und Biotechunternehmen konzentrieren sich hauptsächlich auf Forschung und Entwicklung (F&E), um neue Moleküle für verschiedene therapeutische Anwendungen mit dem größten medizinischen und kommerziellen Potenzial zu entwickeln. Die Unternehmen investieren stark in F&E, um qualitativ hochwertige und innovative Produkte auf den Markt zu bringen. So stiegen beispielsweise die weltweiten Ausgaben für Forschung und Entwicklung im Jahr 2017 im Vergleich zu 2016 um 3,9 Prozent auf 165 Milliarden US-Dollar. Gemessen an den gesamten verschreibungspflichtigen Medikamenteneinnahmen stiegen die durchschnittlichen Ausgaben für Forschung und Entwicklung moderat auf 20,9 Prozent. Laut einer jährlichen Umfrage unter den Mitgliedern der PhRMA gaben Pharmaunternehmen 2017 zudem 71,4 Milliarden US-Dollar für Forschung und Entwicklung aus.
Die Pharmaunternehmen investierten mehr in Forschung und Entwicklung, um ihre klinischen Testprozesse zu beschleunigen. So war AstraZeneca (Stand: 30. Juni 2019) Vorreiter und gab 25,63 % seines Umsatzes für Forschung und Entwicklung aus. Eli Lilly and Company (Stand: 31. März 2019) gab 22,38 % seines Umsatzes für Forschung und Entwicklung aus und Roche Holding AG (Stand: 30. Juni 2019) lag mit 21,29 % für Forschung und Entwicklung dicht dahinter.
Ausgaben für Forschung und Entwicklung fallen in der Regel bei der Entdeckung, Erprobung und Entwicklung neuer Produkte, bei Vorabzahlungen und Meilensteinzahlungen, bei der Verbesserung bestehender Ergebnisse sowie beim Nachweis der Wirksamkeit von Produkten und der Einhaltung gesetzlicher Vorschriften vor der Markteinführung an. Zudem sind die Investitionen von Pharmaunternehmen in den USA in Forschung und Entwicklung in den letzten 15 Jahren kontinuierlich gestiegen.
Die Entwicklung und Entdeckung von Medikamenten ist ein zeitaufwändiger und teurer Prozess. Der Weg von der Früherkennung bzw. dem Design über die Entwicklung bis hin zur behördlichen Zulassung kann mehr als 10 bis 15 Jahre dauern. Während der gesamten Entwicklungsphase eines Arzneimittels sind verschiedene Testverfahren erforderlich, um die Qualität und Wirksamkeit des Produkts zu prüfen. Daher speichern Pharma- und Biotechunternehmen die Daten lieber in elektronischen Masterdateien, um Kosten und Zeit zu sparen, was das Marktwachstum voraussichtlich vorantreiben wird.
Klinische Studien sind einer der wichtigsten und bedeutendsten Schritte in der Medikamentenentdeckung, unabhängig davon, ob die Behandlung, die medizinische Strategie oder das Gerät für die Anwendung bei Menschen oder Tieren sicher und wirksam ist. Klinische Studien helfen, die besten Behandlungsansätze für bestimmte Therapiebereiche zu verstehen und zu bestimmen. Klinische Studien werden speziell durchgeführt, um Daten über die Sicherheit und Wirksamkeit der Entwicklung eines neuen Produkts oder Instruments zu sammeln. Bevor die Zulassungsbehörden die Arzneimittelmoleküle und Medizinprodukte genehmigen, werden eine Reihe klinischer Studien durchgeführt. Die zunehmende Verbreitung verschiedener übertragbarer und nicht übertragbarer Krankheiten erhöht die Nachfrage nach der Entwicklung neuer Arzneimittel oder Medizinprodukte für die Behandlung. Dies wiederum dürfte die Nachfrage nach klinischen Studien für verschiedene Therapiebereiche erhöhen.
Biopharmazeutische und pharmazeutische Unternehmen, die an klinischen Studien beteiligt sind, streben eine Umstellung von papierbasierten Dokumentenmanagementsystemen in Aktenschränken auf elektronische Dokumentenmanagementsysteme an, bei denen Dokumente in elektronischen Online-Archiven gespeichert werden. Durch die Implementierung eines umfassenden eTMF-Systems, das Unternehmen die Automatisierung, Erfassung und Verwaltung von TMF-Dokumenten und Aufzeichnungen ermöglicht, können unnötige Risiken vermieden und häufig Kosteneinsparungen bei klinischen Studien im Vergleich zur manuellen Papierverarbeitung erzielt werden.
Eine zunehmende Einführung eines elektronischen Trial-Master-File-Systems im klinischen Prozess dürfte den Markt ankurbeln. NextDocs von Aurea Software beispielsweise ist ein Forum für elektronische Studienmasterdateien (eTMF) zur klinischen Zusammenarbeit bei der Verwaltung klinischer Studienunterlagen. Es handelt sich um ein Content-Management-System für die Pharmaindustrie, das eine formalisierte Möglichkeit bietet, Dokumente, Fotos und andere digitale Inhalte für klinische Arzneimittelstudien zu organisieren und zu speichern, die möglicherweise zur Einhaltung der Vorschriften staatlicher Aufsichtsbehörden erforderlich sind. Bei klinischen Studien unterstützt die EMA uneingeschränkt die Verwendung von eTMF-Systemen zur elektronischen Speicherung als Ersatz für Papier. In einer Warnmeldung nennt die Agentur Qualitätsprobleme bei TMFs und eTMFs aufgrund von Papierinhalten und Inkonsistenzen wie fehlenden Seiten, ungeeigneter Beschriftung oder unvollständigen Dokumenten. Aufgrund innovativer Funktionen von eTMF, wie Zentralisierung und Verwaltung der Dokumentation klinischer Studien, leistungsstarker Suchfunktionen (mit Metadaten) und mehrerer Methoden zum Hinzufügen von Dokumenten, wird eTMF immer wichtiger für die Geschäftseffizienz, Kosteneinsparungen und kürzere Zeitpläne für die Implementierung elektronischer Dokumentenmanagementprozesse bei der Herstellung von BioPharma-Produkten. Das Geheimnis der Einführung interoperabler eTMF-Frameworks ist die Verwendung eines gemeinsamen Content-Modells. vokabularbasierte Standards und webbasierte Standardtechnologien.
Aufgrund der Weiterentwicklung von Trial Master Files zu elektronischen Trial Master Files übernehmen Auftragsforschungsinstitute sowie Pharma- und Biotechnologieunternehmen das eTMF für ein besseres klinisches Datenmanagement und einen besseren Prozess des klinischen Studienmanagements. Die oben genannten Gründe und Faktoren fördern das Wachstum des Marktes für elektronische Trial Master Files.
Komponentenbasierte Erkenntnisse
In Bezug auf die Komponenten ist das elektronische Trial Master File im Gesundheitsmarkt in Service und Software segmentiert. Das Servicesegment hatte 2019 den größten Marktanteil.
Liefermodusbasierte Erkenntnisse
Basierend auf dem Liefermodus ist das elektronische Trial Master File im Gesundheitsmarkt in Cloud-basiertes ETMF und On-Premise-ETMF segmentiert. Das cloudbasierte eTMF-Segment hatte 2019 den größten Marktanteil.
Endbenutzerbasierte Erkenntnisse
In Bezug auf den Endbenutzer ist der Markt für elektronische Teststammdateien im Gesundheitswesen in Pharma- und Biotechnologieunternehmen, Cross-Roboter und andere segmentiert. Das Segment der Pharma- und Biotechnologieunternehmen hatte 2019 den größten Marktanteil.
Die Akteure des Marktes für elektronische Teststammdateien im Gesundheitswesen verfolgen Strategien zur Produkteinführung und -erweiterung, um den sich weltweit ändernden Kundenanforderungen gerecht zu werden und so ihren Markennamen weltweit zu behaupten.
Markt für elektronische Teststammdateien (eTMF)
Die Analysten von The Insight Partners haben die regionalen Trends und Faktoren, die den Markt für elektronische Teststammdateien (eTMF) im Prognosezeitraum beeinflussen, ausführlich erläutert. In diesem Abschnitt werden auch die Marktsegmente und die geografische Lage für elektronische Teststammdateien (eTMF) in Nordamerika, Europa, im asiatisch-pazifischen Raum, im Nahen Osten und Afrika sowie in Süd- und Mittelamerika erläutert.Umfang des Marktberichts zum Electronic Trial Master File (eTMF)
| Berichtsattribut | Einzelheiten |
|---|---|
| Marktgröße in 2018 | US$ 938.32 Million |
| Marktgröße nach 2027 | US$ 3,155.64 Million |
| Globale CAGR (2018 - 2027) | 16.5% |
| Historische Daten | 2016-2017 |
| Prognosezeitraum | 2019-2027 |
| Abgedeckte Segmente |
By Komponente
|
| Abgedeckte Regionen und Länder |
Nordamerika
|
| Marktführer und wichtige Unternehmensprofile |
|
Dichte der Marktteilnehmer im Bereich Electronic Trial Master File (eTMF): Verständnis der Auswirkungen auf die Geschäftsdynamik
Der Markt für elektronische Teststammdateien (eTMF) wächst rasant. Dies wird durch die steigende Endverbrauchernachfrage aufgrund veränderter Verbraucherpräferenzen, technologischer Fortschritte und eines stärkeren Bewusstseins für die Produktvorteile vorangetrieben. Mit der steigenden Nachfrage erweitern Unternehmen ihr Angebot, entwickeln Innovationen, um den Bedürfnissen der Verbraucher gerecht zu werden, und nutzen neue Trends, was das Marktwachstum weiter ankurbelt.
- Holen Sie sich die Markt für elektronische Trial Master File (eTMF) Übersicht der wichtigsten Akteure
Elektronische Studienstammdatei im Gesundheitsmarkt – nach Komponente
- Dienst
- Software
Elektronische Studienstammdatei im Gesundheitsmarkt – nach Bereitstellungsmodus
- Cloudbasierte eTMF
- On-Premise eTMF
Elektronische Studienstammdatei im Gesundheitsmarkt – nach Endbenutzer
- Pharma- und Biotechnologieunternehmen
- CROs
- Sonstige
Elektronische Studienstammdatei im Gesundheitsmarkt – nach Geografie
-
Nordamerika
- USA
- Kanada
- Mexiko
-
Europa
- Frankreich
- Deutschland
- Italien
- Vereinigtes Königreich
- Spanien
- Rest von Europa
-
Asien-Pazifik (APAC)
- China
- Indien
- Südkorea
- Japan
- Australien
- Rest von APAC
-
Naher Osten und Asien Afrika (MEA)
- Südafrika
- Saudi-Arabien
- VAE
- Rest von MEA
-
Südamerika und Mittelamerika (SCAM)
- Brasilien
- Argentinien
- Rest von SCAM
Unternehmen Profile
- Aurea, Inc.
- Transperfect.
- Covance Inc (Lab Corp)
- Oracle
- Ennov
- Mastercontrol, Inc.
- Omnicomm
- Pharmavigilalnce
- Veeva Systems
- Phlexglobal
- Historische Analyse (2 Jahre), Basisjahr, Prognose (7 Jahre) mit CAGR
- PEST- und SWOT-Analyse
- Marktgröße Wert/Volumen – Global, Regional, Land
- Branchen- und Wettbewerbslandschaft
- Excel-Datensatz
Aktuelle Berichte
Erfahrungsberichte
Grund zum Kauf
- Fundierte Entscheidungsfindung
- Marktdynamik verstehen
- Wettbewerbsanalyse
- Kundeneinblicke
- Marktprognosen
- Risikominimierung
- Strategische Planung
- Investitionsbegründung
- Identifizierung neuer Märkte
- Verbesserung von Marketingstrategien
- Steigerung der Betriebseffizienz
- Anpassung an regulatorische Trends





















 Kostenlose Probe anfordern für - Markt für elektronische Trial Master File (eTMF)
Kostenlose Probe anfordern für - Markt für elektronische Trial Master File (eTMF)