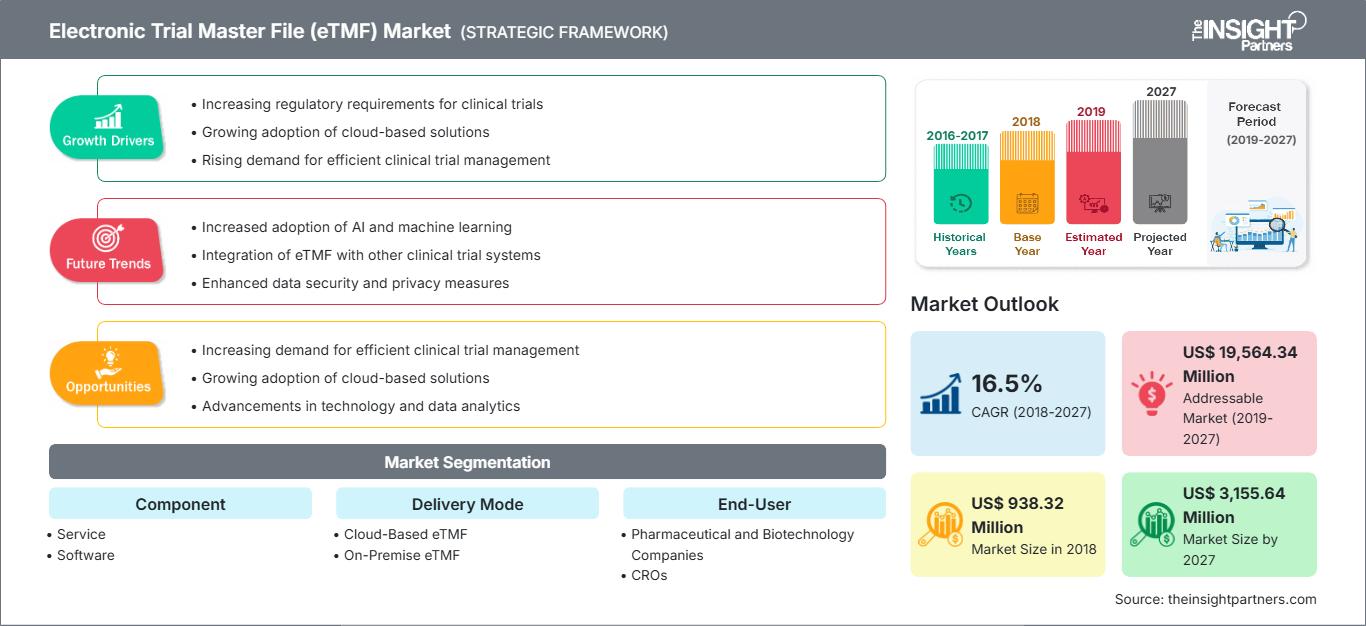
[Rapport de recherche] Le marché des dossiers maîtres d'essais électroniques (eTMF) était évalué à 938,32 millions de dollars américains en 2018 et devrait atteindre 3 155,64 millions de dollars américains d'ici 2027 ; sa croissance devrait atteindre un TCAC de 16,5 % entre 2019 et 2027.
Les systèmes de dossiers maîtres d'essais électroniques (eTMF) peuvent être définis comme une intégration de composants logiciels et matériels collectivement responsables de la gestion optimale des données des essais cliniques. Ces solutions permettent de rationaliser les données générées au cours d'un essai clinique dans un format numérique facile à stocker, qui peut être récupéré par différents utilisateurs, ce qui facilite l'accès et réduit les coûts associés aux opérations administratives et manuelles de maintenance des données dans les essais cliniques. La croissance du marché des dossiers maîtres d'essais électroniques (eTMF) sur le marché des soins de santé est attribuée à l'augmentation du nombre d'essais cliniques, à la prévalence croissante des maladies et aux progrès technologiques qui ont stimulé le marché au fil des ans. Cependant, la pénurie de professionnels qualifiés risque d'avoir un impact négatif sur la croissance du marché dans les années à venir. En revanche, l'augmentation des initiatives stratégiques des acteurs du marché devrait offrir des opportunités de croissance au cours des prochaines années.
Le marché des dossiers électroniques d'essais cliniques (DPI) dans le secteur de la santé devrait connaître une croissance substantielle après la pandémie. La COVID-19 a affecté les économies et les industries de divers pays en raison des confinements, des interdictions de voyager et des fermetures d'entreprises. La crise de la COVID-19 a surchargé les systèmes de santé publique de nombreux pays et a mis en évidence la nécessité impérieuse d'investissements durables dans les systèmes de santé. À mesure que la pandémie de COVID-19 progresse, le secteur de la santé devrait connaître une baisse de croissance. Le secteur des sciences de la vie prospère grâce à la demande accrue de produits de diagnostic in vitro et à l'essor des activités de recherche et développement dans le monde entier. Cependant, le secteur des technologies médicales et de l'imagerie connaît une baisse de ses ventes en raison d'un nombre réduit d'interventions chirurgicales et de retards ou de prolongations dans l'approvisionnement en équipements. De plus, les consultations virtuelles par des professionnels de la santé devraient devenir le modèle de prestation de soins dominant après la pandémie. Avec la télésanté qui transforme la prestation de soins, la santé numérique continuera de prospérer dans les années à venir. De plus, les perturbations des essais cliniques et les retards de lancement de médicaments qui en découlent devraient ouvrir la voie à des essais entièrement virtuels à l'avenir. De nouvelles technologies, comme l'ARNm, devraient émerger et transformer l'industrie pharmaceutique, et le marché devrait également connaître davantage d'intégration verticale et de coentreprises dans les années à venir.
Vous bénéficierez d’une personnalisation sur n’importe quel rapport - gratuitement - y compris des parties de ce rapport, ou une analyse au niveau du pays, un pack de données Excel, ainsi que de profiter d’offres exceptionnelles et de réductions pour les start-ups et les universités
Marché du fichier maître d'essai électronique (eTMF): Perspectives stratégiques
-
Obtenez les principales tendances clés du marché de ce rapport.Cet échantillon GRATUIT comprendra une analyse de données, allant des tendances du marché aux estimations et prévisions.
Les sociétés pharmaceutiques ont investi davantage en R&D pour accélérer leur processus d'essais cliniques. Par exemple, au 30 juin 2019, AstraZeneca a ouvert la voie en consacrant 25,63 % de son chiffre d'affaires à la recherche et au développement ; au 31 mars 2019, Holding Strong, Eli Lilly and Company a consacré 22,38 % de son chiffre d'affaires à la R&D, et au 30 juin 2019, Roche Holding AG n'était pas loin derrière avec 21,29 % consacrés à la R&D.
Les dépenses de recherche et développement sont généralement engagées lors des processus de découverte, de test et de développement de nouveaux produits, des paiements initiaux et des étapes clés, de l'amélioration des résultats existants, ainsi que de la démonstration de l'efficacité du produit et de la conformité réglementaire avant son lancement. De plus, les investissements en R&D des sociétés pharmaceutiques américaines ont augmenté de manière constante au cours des 15 dernières années.
Le développement et la découverte de médicaments sont des processus longs et coûteux. Le processus, de la détection précoce ou de la conception au développement et à l'approbation réglementaire, peut prendre plus de 10 à 15 ans. Tout au long de la phase de développement d'une substance médicamenteuse, divers services de test sont nécessaires pour vérifier la qualité et l'efficacité du produit. Par conséquent, les sociétés pharmaceutiques et biotechnologiques préfèrent enregistrer les données dans un fichier maître électronique afin de réduire les coûts et de gagner du temps, ce qui devrait stimuler la croissance du marché.
Les essais cliniques sont l'une des étapes les plus importantes et les plus significatives de la découverte de médicaments, que le traitement, la stratégie médicale ou le dispositif soit sûr et efficace pour un usage humain ou vétérinaire. Les études cliniques aident à comprendre et à déterminer les meilleures approches thérapeutiques pour certains domaines thérapeutiques. Les essais cliniques sont réalisés spécifiquement pour recueillir des données sur la sécurité et l'efficacité du développement d'un nouveau produit ou outil. Avant que les autorités réglementaires n'approuvent les molécules médicamenteuses et les dispositifs médicaux, une série d'études cliniques est réalisée. La prévalence croissante de diverses maladies transmissibles et non transmissibles accroît la demande de développement de nouveaux médicaments ou dispositifs médicaux pour leur traitement. Cela devrait à son tour accroître la demande d'activités d'essais cliniques dans divers domaines thérapeutiques.
Les entreprises biopharmaceutiques et pharmaceutiques impliquées dans les essais cliniques souhaitent passer des systèmes de gestion documentaire papier dans des classeurs à des systèmes de gestion documentaire électronique, où les documents sont stockés dans des archives électroniques en ligne. La mise en œuvre d'un système eTMF complet, permettant aux organisations d'automatiser, de capturer et de gérer les documents et les enregistrements TMF, permet d'éviter les risques inutiles et de réaliser des économies sur les coûts des essais cliniques par rapport aux processus manuels de traitement papier.
L'adoption croissante d'un système de fichier maître d'essai électronique dans le processus clinique devrait stimuler le marché. Par exemple, NextDocs d'Aurea Software est un forum de gestion de fichiers maîtres d'essais électroniques (eTMF) pour la coopération clinique dans la gestion des dossiers d'essais cliniques. Il s'agit d'un système de gestion de contenu destiné à l'industrie pharmaceutique. Il offre un moyen formalisé d'organiser et de stocker des documents, des photographies et d'autres contenus numériques pour les essais cliniques pharmaceutiques, susceptibles d'être soumis à la réglementation gouvernementale. Dans le cadre des essais cliniques, l'EMA soutient pleinement l'utilisation de systèmes eTMF pour le stockage électronique, en remplacement du papier. L'agence met en garde contre les problèmes de qualité rencontrés avec les TMF et les eTMF, liés au contenu papier et à des incohérences telles que des pages manquantes, un étiquetage inapproprié ou des documents incomplets. Grâce à ses fonctionnalités innovantes, telles que la centralisation et la gestion de la documentation des essais cliniques, ses puissantes capacités de recherche (avec métadonnées) et ses multiples méthodes d'ajout de documents, eTMF devient un outil essentiel pour l'efficacité opérationnelle, la réduction des coûts et la réduction des délais de production des produits biopharmaceutiques, afin de mettre en œuvre des processus de gestion électronique des documents. Le secret de l'introduction de cadres eTMF interopérables réside dans l'utilisation d'un modèle de contenu commun, de normes basées sur un vocabulaire précis et de technologies de normalisation web.
Grâce à l'évolution du fichier maître d'essai électronique (EME), les organismes de recherche sous contrat et les sociétés pharmaceutiques et biotechnologiques adoptent l'eTMF pour une meilleure gestion des données cliniques et des essais cliniques. Les raisons et facteurs mentionnés ci-dessus contribuent à la croissance du marché des EME.
Informations basées sur les composants
En termes de composants, le fichier maître d'essai électronique (EME) sur le marché de la santé est segmenté en services et en logiciels. Le segment des services détenait la plus grande part de marché en 2019.
Informations basées sur le mode de livraison
En fonction du mode de livraison, le fichier maître d'essai électronique (EME) sur le marché de la santé est segmenté en EME basé sur le cloud et en EME sur site. Le segment des eTMF basés sur le cloud détenait la plus grande part de marché en 2019.
Informations sur l'utilisateur final
En termes d'utilisateur final, le marché des dossiers permanents d'essais cliniques électroniques (eTMF) dans le secteur de la santé est segmenté en sociétés pharmaceutiques et biotechnologiques, entreprises de recherche et développement (CRS) et autres. Ce segment détenait la plus grande part de marché en 2019.
Les acteurs du marché des dossiers permanents d'essais cliniques électroniques (eTMF) dans le secteur de la santé adoptent des stratégies de lancement et d'expansion de produits pour répondre à l'évolution de la demande des clients à l'échelle mondiale, ce qui leur permet également de préserver leur image de marque à l'échelle mondiale.
Marché du fichier maître d'essai électronique (eTMF)
Les tendances régionales et les facteurs influençant le marché du fichier maître d'essai électronique (eTMF) tout au long de la période de prévision ont été analysés en détail par les analystes de The Insight Partners. Cette section aborde également les segments de marché et la répartition géographique du fichier maître d'essai électronique (eTMF) en Amérique du Nord, en Europe, en Asie-Pacifique, au Moyen-Orient et en Afrique, ainsi qu'en Amérique du Sud et en Amérique centrale.
Portée du rapport sur le marché du fichier maître d'essai électronique (eTMF)
| Attribut de rapport | Détails |
|---|---|
| Taille du marché en 2018 | US$ 938.32 Million |
| Taille du marché par 2027 | US$ 3,155.64 Million |
| TCAC mondial (2018 - 2027) | 16.5% |
| Données historiques | 2016-2017 |
| Période de prévision | 2019-2027 |
| Segments couverts |
By Composant
|
| Régions et pays couverts |
Amérique du Nord
|
| Leaders du marché et profils d'entreprises clés |
|
Densité des acteurs du marché du fichier maître d'essai électronique (eTMF) : comprendre son impact sur la dynamique des entreprises
Le marché des dossiers maîtres d'essais électroniques (eTMF) connaît une croissance rapide, portée par une demande croissante des utilisateurs finaux, due à des facteurs tels que l'évolution des préférences des consommateurs, les avancées technologiques et une meilleure connaissance des avantages du produit. Face à cette demande croissante, les entreprises élargissent leur offre, innovent pour répondre aux besoins des consommateurs et capitalisent sur les nouvelles tendances, ce qui alimente la croissance du marché.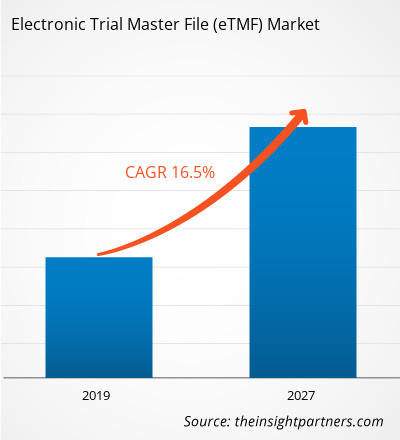
- Obtenez le Marché du fichier maître d'essai électronique (eTMF) Aperçu des principaux acteurs clés
Dossier maître d'essai électronique sur le marché de la santé - par composant
- Service
- Logiciel
Dossier maître d'essai électronique sur le marché de la santé - par mode de livraison
- eTMF basé sur le cloud
- eTMF sur site
Dossier maître d'essai électronique sur le marché de la santé - par utilisateur final
- Sociétés pharmaceutiques et de biotechnologie
- CRO
- Autres
Dossier maître d'essai électronique sur le marché de la santé - par utilisateur final par géographie
-
Amérique du Nord
- États-Unis
- Canada
- Mexique
-
Europe
- France
- Allemagne
- Italie
- Royaume-Uni
- Espagne
- Reste de la Europe
-
Asie-Pacifique (APAC)
- Chine
- Inde
- Corée du Sud
- Japon
- Australie
- Reste de l'APAC
-
Moyen-Orient et amp; Afrique (MEA)
- Afrique du Sud
- Arabie Saoudite
- EAU
- Reste de la MEA
-
Amérique du Sud et Amérique centrale (SCAM)
- Brésil
- Argentine
- Reste de la SCAM
Société Profils
- Aurea, Inc.
- Transperfect.
- Covance Inc (Lab Corp)
- Oracle
- Ennov
- Mastercontrol, Inc.
- Omnicomm
- Pharmavigilance
- Veeva Systems
- Phlexglobal
- Analyse historique (2 ans), année de base, prévision (7 ans) avec TCAC
- Analyse PEST et SWOT
- Taille du marché Valeur / Volume - Mondial, Régional, Pays
- Industrie et paysage concurrentiel
- Ensemble de données Excel
Rapports récents
Témoignages
Raison d'acheter
- Prise de décision éclairée
- Compréhension de la dynamique du marché
- Analyse concurrentielle
- Connaissances clients
- Prévisions de marché
- Atténuation des risques
- Planification stratégique
- Justification des investissements
- Identification des marchés émergents
- Amélioration des stratégies marketing
- Amélioration de l'efficacité opérationnelle
- Alignement sur les tendances réglementaires





















 Obtenez un échantillon gratuit pour - Marché du fichier maître d'essai électronique (eTMF)
Obtenez un échantillon gratuit pour - Marché du fichier maître d'essai électronique (eTMF)