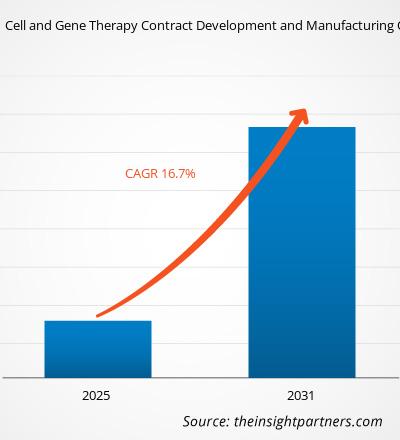
Le marché des organisations de développement et de fabrication de thérapies cellulaires et géniques sous contrat devrait atteindre 31,86 milliards de dollars US d'ici 2031, contre 6,22 milliards de dollars US en 2024. Le marché devrait enregistrer un TCAC de 26,4 % entre 2025 et 2031. L'intégration croissante de l'IA et de la transformation numérique devrait entraîner de nouvelles tendances de marché au cours de la période de prévision.
Analyse du marché des organisations de développement et de fabrication de contrats de thérapie cellulaire et génique
Les thérapies cellulaires et géniques nécessitent des procédés de fabrication spécialisés, notamment la production de vecteurs viraux, de cellules transduites et d'autres matériaux biologiques spécialisés. Ces thérapies ciblent des maladies rares ou complexes, telles que les maladies génétiques, le cancer et les maladies auto-immunes. Selon l'Alliance pour la médecine régénérative (ARM), le nombre total d'essais cliniques axés sur les seules thérapies géniques a dépassé le millier en 2024, et des centaines d'autres sont en cours de réalisation, ce qui crée un besoin croissant d'organisations de développement et de fabrication sous contrat (CDMO).
L'arrivée croissante de start-ups biotechnologiques et de sociétés biopharmaceutiques dans le secteur des thérapies géniques et cellulaires a stimulé la demande de CDMO. Les sociétés biopharmaceutiques, en particulier les PME, manquent de l'infrastructure et de l'expertise nécessaires à la fabrication de ces thérapies spécialisées. Par conséquent, elles se tournent vers les CDMO pour leur expertise complète en matière de gestion de la production des essais cliniques, de conformité réglementaire et de mise à l'échelle des processus de fabrication. Le partenariat entre Autologus Therapeutics et AGC Biologics Milan a débuté en 2020, lorsque l'entreprise a participé au développement, à la fabrication et à la fourniture de vecteurs viraux pour AUCATZYL, le candidat produit CAR-T obe-cel d'Autolus. La collaboration entre les deux parties a été essentielle pour la mise sur le marché rapide de la thérapie. En mai 2025, Astraveus SAS a conclu un partenariat stratégique avec le Centre néerlandais pour le progrès clinique des thérapies par cellules souches et géniques (NecstGen) afin d'évaluer l'usine cellulaire de paillasse de Lakhesys pour la fabrication de thérapies CAR-T.
Les avancées technologiques telles que l'intelligence artificielle (IA) optimisent les processus de fabrication pour les essais cliniques. Ces innovations permettent des méthodes de production efficaces et rentables, essentielles compte tenu de la complexité des essais. Ainsi, l'augmentation des essais cliniques pour des thérapies innovantes, conjuguée à la demande croissante de CDMO pour accroître la recherche, le développement et la commercialisation, stimule la croissance du marché des organisations de développement et de fabrication sous contrat de thérapies cellulaires et géniques.
Aperçu du marché des organisations de développement et de fabrication sous contrat de thérapie cellulaire et génique
Le marché des organisations de développement et de fabrication sous contrat de thérapies cellulaires et géniques est en pleine expansion grâce à la multiplication des essais cliniques pour des thérapies innovantes et à la forte hausse des autorisations réglementaires et de la commercialisation. Les principaux acteurs du marché privilégient l'innovation et la collaboration pour optimiser la disponibilité et la portée des produits. En avril 2025, AGC Biologics a lancé une nouvelle division dédiée aux technologies cellulaires et génétiques. Cette nouvelle division se concentrera sur le renforcement des capacités existantes d'AGC Biologics et sur le soutien aux développeurs qui ont besoin de capacités, de compétences scientifiques et d'opérateurs CDMO cellulaires et génétiques techniquement qualifiés. Le Centre d'excellence cellulaire et génétique d'AGC Biologics à Milan sera le site central de cette nouvelle division. Fort de 30 ans d'expérience en thérapie cellulaire et génique, ce site compte neuf autorisations commerciales et des centaines de lots BPF produits avec succès. Cependant, la grande complexité de fabrication des organisations de développement et de fabrication sous contrat de thérapies cellulaires et géniques freine la croissance du marché.
Personnalisez ce rapport en fonction de vos besoins
Vous bénéficierez d'une personnalisation gratuite de n'importe quel rapport, y compris des parties de ce rapport, ou d'une analyse au niveau des pays, d'un pack de données Excel, ainsi que de superbes offres et réductions pour les start-ups et les universités.
Marché des organisations de développement et de fabrication sous contrat de thérapie cellulaire et génique : perspectives stratégiques

-
Obtenez les principales tendances clés du marché de ce rapport.Cet échantillon GRATUIT comprendra une analyse de données, allant des tendances du marché aux estimations et prévisions.
Moteurs et opportunités du marché des organisations de développement et de fabrication de contrats de thérapie cellulaire et génique
Augmentation des approbations réglementaires et de la commercialisation
Ces dernières années, la Food and Drug Administration (FDA) américaine et l'Agence européenne des médicaments (EMA) ont simplifié leurs processus d'approbation des thérapies cellulaires et géniques. Ce processus accéléré permet une mise sur le marché plus rapide de thérapies innovantes et accroît la demande de services de fabrication spécialisés fournis par les CDMO. L'une des principales raisons de ce changement est la reconnaissance des thérapies cellulaires et géniques dans le traitement de maladies auparavant incurables. La FDA a introduit les désignations « Thérapie avancée en médecine régénératrice » (RMAT) et « Thérapie révolutionnaire », qui accélèrent le développement et l'évaluation des thérapies prometteuses. Ces désignations contribuent à accélérer l'approbation des thérapies cellulaires et géniques. Zolgensma, une thérapie génique pour l'amyotrophie spinale (SMA), a reçu sa première approbation de la FDA en 2019. D'ici 2024, il sera approuvé dans 51 autres pays en seulement quatre ans, un processus qui prendrait normalement beaucoup plus de temps. Cette approbation rapide représente l'impulsion réglementaire nécessaire pour mettre sur le marché des thérapies révolutionnaires. Selon l’Alliance pour la médecine régénérative (ARM), plus de 24 thérapies géniques ont reçu une approbation réglementaire à l’échelle mondiale depuis 2020, et de nombreuses autres sont en cours de développement.
Accès à des installations et technologies spécialisées
La demande en thérapies cellulaires et géniques pousse les entreprises biopharmaceutiques vers les CDMO (Centres de Développement de Produits de Fabrication) capables de fournir des installations et des technologies de pointe, nécessaires à l'intensification de la production tout en garantissant la qualité, la conformité et l'approbation réglementaire. Ces capacités spécialisées sont essentielles à la production de thérapies complexes et personnalisées, qui nécessitent une infrastructure de pointe pour maintenir des normes de fabrication élevées. Les thérapies cellulaires et géniques, notamment l'édition génomique, la production de vecteurs viraux et la médecine personnalisée, nécessitent des installations spécialisées équipées des technologies les plus récentes. La production de vecteurs viraux utilisés en thérapies géniques nécessite des installations conformes aux BPF afin de garantir la sécurité, la cohérence et la qualité du produit final. Ces installations doivent être équipées pour manipuler des cellules vivantes et des organismes génétiquement modifiés dans des environnements contrôlés et surveillés. L'adoption croissante de systèmes automatisés de culture cellulaire, de fabrication continue et de systèmes numériques de contrôle qualité favorise la croissance et l'efficacité de la production de thérapies géniques. En mars 2025, Bharat Biotech a investi 75 millions de dollars américains dans sa première installation de thérapie cellulaire et génique dans le sud de l'Inde. L'entreprise devrait lancer de nouvelles thérapies au cours des trois prochaines années pour l'oncologie et les maladies rares.
Le besoin d'installations spécialisées crée une opportunité considérable pour les CDMO. Collaborer avec des CDMO disposant de la technologie et des installations nécessaires est rentable et efficace pour les entreprises biopharmaceutiques. En 2023, Bristol-Myers Squibb a collaboré avec une CDMO pour la production de Breyanzi, sa thérapie cellulaire CAR-T. Cette thérapie implique la récolte, la modification et l'amplification des lymphocytes T d'un patient, un processus nécessitant une technologie et des installations spécialisées pour garantir l'effet thérapeutique souhaité. En s'appuyant sur l'expertise des CDMO dans des installations spécialisées, Bristol-Myers Squibb a pu accroître sa production tout en garantissant la conformité réglementaire et la qualité. Ainsi, le besoin croissant de capacités de fabrication avancées et de technologies de pointe devrait créer des opportunités de croissance pour le marché des organismes de recherche et développement sous contrat en thérapie cellulaire et génique.
Analyse de segmentation du rapport sur le marché des organisations de développement et de fabrication de contrats de thérapie cellulaire et génique
Les segments clés qui ont contribué à l’élaboration de l’analyse du marché du développement et de la fabrication de contrats de thérapie cellulaire et génique sont le type de service, le type de produit et l’utilisateur final.
- Selon le type de service, le marché des organisations de développement et de fabrication sous contrat de thérapies cellulaires et géniques est segmenté en : développement et fabrication de médicaments, services de tests et de réglementation, et autres. Le segment du développement et de la fabrication de médicaments détenait la plus grande part de marché en 2024.
- En termes de type de produit, le marché des organisations de développement et de fabrication sous contrat de thérapie cellulaire et génique se divise en deux catégories : la thérapie génique et la thérapie cellulaire. Le segment de la thérapie cellulaire a dominé le marché en 2024.
- En termes d'utilisateur final, le marché des organisations de développement et de fabrication sous contrat de thérapies cellulaires et géniques se divise en sociétés pharmaceutiques, sociétés biopharmaceutiques et autres. Le segment des sociétés biopharmaceutiques a dominé le marché en 2024.
Analyse des parts de marché des organisations de développement et de fabrication de contrats de thérapie cellulaire et génique par zone géographique
Le rapport sur le marché des organisations de développement et de fabrication sous contrat de thérapie cellulaire et génique se concentre principalement sur cinq régions : l'Amérique du Nord, l'Asie-Pacifique, l'Europe, l'Amérique du Sud et centrale, ainsi que le Moyen-Orient et l'Afrique. En termes de chiffre d'affaires, l'Amérique du Nord a dominé le marché en 2024 et devrait maintenir cette domination sur le marché mondial au cours de la période de prévision. Les États-Unis connaissent des avancées croissantes en biotechnologie, une prévalence croissante des maladies génétiques et une forte demande de services de fabrication spécialisés. Selon les estimations du Government Accountability Office (GAO) américain publiées en octobre 2021, environ 25 à 30 millions de personnes souffrent de maladies rares dans le pays. Selon la Food and Drug Administration (FDA), plus de 7 000 maladies rares touchent plus de 30 millions de personnes dans le pays. La compréhension croissante de ces maladies a entraîné une forte augmentation du développement des thérapies géniques. Les CDMO jouent un rôle crucial dans ce secteur en fournissant des services spécialisés pour le développement et la fabrication de thérapies géniques ciblant les maladies génétiques rares.
En 2023, la FDA américaine a approuvé de nombreuses thérapies cellulaires et géniques, notamment des traitements par modification génétique ciblant les maladies rares. Des thérapies telles que l'exagammglogène autotemcel (Casgevy) et le lovotibeglogène autotemcel pour la drépanocytose, ainsi que le valoctocogène roxaparvovec pour l'hémophilie A sévère, ont reçu l'approbation de la FDA, soulignant le potentiel des thérapies géniques pour relever les défis posés par les maladies rares. Les procédures réglementaires accélérées, telles que la désignation « Thérapie avancée en médecine régénératrice » (RMAT), ont incité les entreprises de biotechnologie à s'associer à des CDMO pour accroître leur production.
Les investissements dans les infrastructures de production ont stimulé la croissance du marché. Le Consortium national de fabrication de cellules, fruit d'une collaboration entre 15 instituts universitaires, plus de 25 entreprises et des agences gouvernementales, vise à permettre une production rentable et à grande échelle de thérapies cellulaires. De plus, les collaborations stratégiques entre les CDMO, les établissements universitaires et les entreprises biopharmaceutiques contribuent également à la croissance du marché.
Perspectives régionales du marché des organisations de développement et de fabrication de contrats de thérapie cellulaire et génique
Les tendances et facteurs régionaux influençant le marché des organisations de développement et de fabrication sous contrat de thérapie cellulaire et génique au cours de la période de prévision ont été analysés en détail par les analystes d'Insight Partners. Cette section aborde également les segments et la géographie du marché des organisations de développement et de fabrication sous contrat de thérapie cellulaire et génique en Amérique du Nord, en Europe, en Asie-Pacifique, au Moyen-Orient et en Afrique, ainsi qu'en Amérique du Sud et en Amérique centrale.
- Obtenez les données régionales spécifiques au marché des organisations de développement et de fabrication sous contrat de thérapie cellulaire et génique
Portée du rapport sur le marché des organisations de développement et de fabrication de contrats de thérapie cellulaire et génique
| Attribut de rapport | Détails |
|---|---|
| Taille du marché en 2024 | 6,22 milliards de dollars américains |
| Taille du marché d'ici 2031 | 31,86 milliards de dollars américains |
| TCAC mondial (2025 - 2031) | 26,4% |
| Données historiques | 2021-2023 |
| Période de prévision | 2025-2031 |
| Segments couverts |
Par type de service
|
| Régions et pays couverts |
Amérique du Nord
|
| Leaders du marché et profils d'entreprises clés |
|
Densité des acteurs du marché du développement et de la fabrication de contrats de thérapie cellulaire et génique : comprendre son impact sur la dynamique commerciale
Le marché des organisations de développement et de fabrication sous contrat de thérapie cellulaire et génique connaît une croissance rapide, portée par une demande croissante des utilisateurs finaux, due à des facteurs tels que l'évolution des préférences des consommateurs, les avancées technologiques et une meilleure connaissance des avantages du produit. Face à cette demande croissante, les entreprises élargissent leur offre, innovent pour répondre aux besoins des consommateurs et capitalisent sur les nouvelles tendances, ce qui alimente la croissance du marché.
La densité des acteurs du marché désigne la répartition des entreprises opérant sur un marché ou un secteur particulier. Elle indique le nombre de concurrents (acteurs) présents sur un marché donné par rapport à sa taille ou à sa valeur marchande totale.
Les principales entreprises opérant sur le marché des organisations de développement et de fabrication sous contrat de thérapie cellulaire et génique sont :
- WuXi Biologics Inc
- Charles River Laboratories International Inc
- Catalent Inc
- Lonza Group AG
- Thermo Fisher Scientific Inc.
- AGC Biologics AS
Avertissement : Les entreprises répertoriées ci-dessus ne sont pas classées dans un ordre particulier.
- Obtenez un aperçu des principaux acteurs du marché des organisations de développement et de fabrication de contrats de thérapie cellulaire et génique
Actualités et développements récents du marché des organisations de développement et de fabrication de contrats de thérapie cellulaire et génique
Le marché des organisations de développement et de fabrication sous contrat de thérapies cellulaires et géniques est évalué en collectant des données qualitatives et quantitatives issues de recherches primaires et secondaires, incluant des publications d'entreprises importantes, des données d'associations et des bases de données. Voici les principales évolutions observées sur ce marché :
- WuXi Biologics lance la plateforme d'expression microbienne EffiX pour stimuler la production de protéines recombinantes et d'ADN plasmidique. (Source : WuXi Biologics, mars 2025)
- Charles River Laboratories International, Inc. et AAVantgarde ont annoncé un accord de CDMO pour la production d'ADN plasmidique conforme aux Bonnes Pratiques de Fabrication (BPF). AAVantgarde, société de biotechnologie en phase clinique disposant de deux plateformes propriétaires de vecteurs viraux adéno-associés (AAV) pour l'administration de gènes de grande taille et le développement de produits pour le traitement des maladies rétiniennes héréditaires, s'appuiera sur l'expertise de Charles River en matière de production d'ADN plasmidique conforme aux Bonnes Pratiques de Fabrication (BPF). (Source : Charles River Laboratories International, Inc., juillet 2024)
- Siren Biotechnology, pionnier de la thérapie immunogénique universelle AAV contre le cancer, a conclu un partenariat stratégique avec Catalent Inc., leader dans le développement et la fourniture de meilleurs traitements pour les patients du monde entier, afin de soutenir le développement et la fabrication des thérapies immunogéniques AAV de Siren Biotechnology. (Source : Catalent Inc., communiqué de presse, mai 2024)
Rapport sur le marché des organisations de développement et de fabrication de contrats de thérapie cellulaire et génique, couverture et livrables
Le rapport « Taille et prévisions du marché des organisations de développement et de fabrication de contrats de thérapie cellulaire et génique (2021-2031) » fournit une analyse détaillée du marché couvrant les domaines suivants :
- Taille et prévisions du marché des dispositifs de fermeture des plaies aux niveaux mondial, régional et national pour tous les segments de marché clés couverts par le champ d'application
- Tendances du marché des dispositifs de fermeture des plaies, ainsi que la dynamique du marché, telles que les moteurs, les contraintes et les opportunités clés
- Analyse PEST et SWOT détaillée
- Analyse du marché des dispositifs de fermeture des plaies couvrant les principales tendances du marché, le cadre mondial et régional, les principaux acteurs, les réglementations et les développements récents du marché
- Analyse du paysage industriel et de la concurrence couvrant la concentration du marché, l'analyse de la carte thermique, les principaux acteurs et les développements récents pour le marché du développement sous contrat et de l'organisation de fabrication de thérapies cellulaires et géniques
- Profils d'entreprise détaillés
- Analyse historique (2 ans), année de base, prévision (7 ans) avec TCAC
- Analyse PEST et SWOT
- Taille du marché Valeur / Volume - Mondial, Régional, Pays
- Industrie et paysage concurrentiel
- Ensemble de données Excel
Rapports récents
Témoignages
Raison d'acheter
- Prise de décision éclairée
- Compréhension de la dynamique du marché
- Analyse concurrentielle
- Connaissances clients
- Prévisions de marché
- Atténuation des risques
- Planification stratégique
- Justification des investissements
- Identification des marchés émergents
- Amélioration des stratégies marketing
- Amélioration de l'efficacité opérationnelle
- Alignement sur les tendances réglementaires





















 Obtenez un échantillon gratuit pour - Marché des organisations de développement et de fabrication sous contrat de thérapie cellulaire et génique
Obtenez un échantillon gratuit pour - Marché des organisations de développement et de fabrication sous contrat de thérapie cellulaire et génique