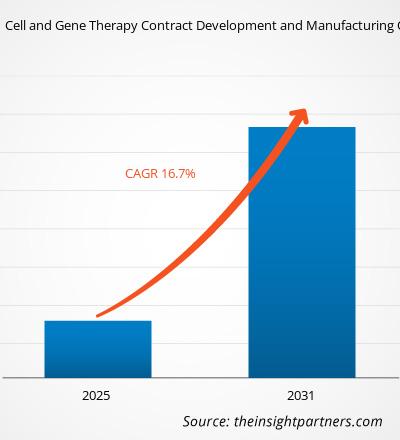
Si prevede che il mercato delle organizzazioni di sviluppo e produzione a contratto per la terapia cellulare e genica raggiungerà i 31,86 miliardi di dollari entro il 2031, rispetto ai 6,22 miliardi di dollari del 2024. Si prevede che il mercato registrerà un CAGR del 26,4% nel periodo 2025-2031. La crescente integrazione tra intelligenza artificiale e trasformazione digitale porterà probabilmente nuove tendenze di mercato durante il periodo di previsione.
Analisi di mercato delle organizzazioni di sviluppo e produzione di contratti per la terapia cellulare e genica
Le terapie cellulari e geniche richiedono processi di produzione specializzati, tra cui la produzione di vettori virali, cellule trasdotte e altri materiali biologici specializzati. Queste terapie sono mirate a malattie rare o complesse, come malattie genetiche, tumori e malattie autoimmuni. Secondo l'Alliance for Regenerative Medicine (ARM), il numero totale di studi clinici incentrati solo sulle terapie geniche ha superato le 1.000 unità nel 2024, con centinaia di altri in fase di sviluppo, creando così la domanda di organizzazioni di sviluppo e produzione a contratto (CDMO).
Il crescente numero di startup biotecnologiche e aziende biofarmaceutiche che si stanno affacciando al settore della terapia genica e cellulare ha fatto crescere la domanda di CDMO. Le aziende biofarmaceutiche, in particolare le piccole e medie imprese, non dispongono delle infrastrutture e delle competenze necessarie per la produzione di queste terapie specializzate. Di conseguenza, si rivolgono alle CDMO per la loro competenza completa nella gestione della produzione per gli studi clinici, nel garantire la conformità normativa e nell'incremento dei processi produttivi. La partnership tra Autologus Therapeutics e AGC Biologics Milano è iniziata nel 2020, quando l'azienda si è occupata dello sviluppo, della produzione e della fornitura di vettori virali per il candidato prodotto CAR-T obe-cel di Autolus, AUCATZYL. La collaborazione tra le due parti è stata determinante per il rapido lancio della terapia sul mercato. Nel maggio 2025, Astraveus SAS ha avviato una partnership strategica con il Netherlands Center for the Clinical Advancement of Stem Cell and Gene Therapies (NecstGen) per valutare la fabbrica di cellule da banco Lakhesys per la produzione di terapie CAR-T.
I progressi tecnologici come l'intelligenza artificiale (IA) ottimizzano i processi di produzione per le sperimentazioni cliniche. Queste innovazioni consentono metodi di produzione efficienti ed economici, fondamentali data la complessità delle attività. Pertanto, l'aumento delle sperimentazioni cliniche per terapie innovative, insieme alla crescente domanda di CDMO per incrementare la ricerca, lo sviluppo e la commercializzazione, guidano la crescita del mercato delle organizzazioni di sviluppo e produzione a contratto per la terapia cellulare e genica.CDMOs for increasing research, development, and commercialization, drive the growth of the
Panoramica del mercato delle organizzazioni di sviluppo e produzione di contratti per la terapia cellulare e genica
Il mercato delle organizzazioni di sviluppo e produzione a contratto per terapie cellulari e geniche è in espansione grazie all'aumento degli studi clinici per terapie innovative e all'aumento delle approvazioni normative e della commercializzazione. I principali attori del mercato si stanno concentrando sull'innovazione e sulla collaborazione per migliorare la disponibilità e la diffusione dei prodotti. Nell'aprile 2025, AGC Biologics ha lanciato una nuova divisione dedicata a Cell and Gene Business. La nuova divisione Cell and Gene Technologies si concentrerà sull'espansione delle competenze di AGC Biologics e sul supporto agli sviluppatori che necessitano di capacità, competenze scientifiche e operatori CDMO (Cell and Gene Development) tecnicamente qualificati. Il Centro di Eccellenza Cell and Gene di AGC Biologics a Milano sarà la sede centrale di questa nuova divisione. Il sito offre 30 anni di esperienza nella terapia cellulare e genica, con nove approvazioni commerciali e centinaia di lotti GMP prodotti con successo. Tuttavia, l'elevata complessità produttiva nelle organizzazioni di sviluppo e produzione a contratto per terapie cellulari e geniche ostacola la crescita del mercato.AGC Biologics Launched a New Dedicated Cell and Gene Business Division. The new Cell and Gene Technologies Division will focus on elevating existing AGC Biologics capabilities and supporting developers who require capacity, scientific capabilities, and technically qualified cell and gene CDMO operators. The AGC Biologics Milan Cell and Gene Center of Excellence will be the central location for this new Division. The site offers 30 years of experience in cell and gene therapy, with nine commercial approvals and hundreds of GMP batches produced successfully. However, the high manufacturing complexities in cell and gene therapy contract development and manufacturing organizations hinder market growth.
Personalizza questo report in base alle tue esigenze
Riceverai la personalizzazione gratuita di qualsiasi report, incluse parti di questo report, analisi a livello nazionale, pacchetto dati Excel e potrai usufruire di fantastiche offerte e sconti per start-up e università.
Sviluppo e produzione di contratti per la terapia cellulare e genica: approfondimenti strategici

-
Scopri le principali tendenze di mercato di questo rapporto.Questo campione GRATUITO includerà analisi di dati che spaziano dalle tendenze di mercato alle stime e alle previsioni.
Driver di mercato e opportunità per l'organizzazione di sviluppo e produzione di contratti di terapia cellulare e genica
Aumento delle approvazioni normative e della commercializzazione
Negli ultimi anni, la Food and Drug Administration (FDA) statunitense e l'Agenzia Europea per i Medicinali (EMA) hanno semplificato i processi di approvazione per le terapie cellulari e geniche. La procedura accelerata consente un ingresso più rapido sul mercato per le terapie innovative e aumenta la domanda di servizi di produzione specializzati forniti dalle CDMO. Uno dei motivi principali di questo cambiamento è il riconoscimento delle terapie cellulari e geniche nel trattamento di malattie precedentemente incurabili. La FDA ha introdotto la designazione di Terapia Avanzata di Medicina Rigenerativa (RMAT) e la designazione di Terapia Innovativa (Breakthrough Therapy Designation), che accelerano lo sviluppo e la revisione di terapie promettenti. Queste designazioni contribuiscono a un'approvazione più rapida delle terapie cellulari e geniche. Zolgensma, una terapia genica per l'atrofia muscolare spinale (SMA), ha ricevuto la sua prima approvazione dalla FDA nel 2019. Entro il 2024, sarà approvato in altri 51 paesi in soli quattro anni, un processo che normalmente richiederebbe molto più tempo. Questa rapida approvazione rappresenta la spinta normativa per immettere sul mercato terapie in grado di cambiare la vita. Secondo l'Alliance for Regenerative Medicine (ARM), dal 2020 oltre 24 terapie geniche hanno ricevuto l'approvazione normativa a livello globale e molte altre sono in fase di sviluppo.
Accesso a strutture e tecnologie specializzate
La domanda di terapie cellulari e geniche sta indirizzando le aziende biofarmaceutiche verso i CDMO (Centre of Medicine and Medicine Organization) in grado di fornire strutture e tecnologie all'avanguardia, necessarie per aumentare la produzione garantendo al contempo qualità, conformità e approvazione normativa. Queste competenze specialistiche sono essenziali per la produzione di terapie complesse e personalizzate, che richiedono infrastrutture avanzate per mantenere elevati standard di produzione. Le terapie cellulari e geniche, tra cui l'editing genetico, la produzione di vettori virali e la medicina personalizzata, richiedono strutture specializzate dotate delle più recenti tecnologie. La produzione di vettori virali utilizzati nelle terapie geniche richiede strutture conformi agli standard GMP per garantire la sicurezza, la coerenza e la qualità del prodotto finale. Queste strutture devono essere attrezzate per gestire cellule vive e organismi geneticamente modificati in ambienti controllati e monitorati. La crescente adozione di sistemi automatizzati per colture cellulari, produzione continua e sistemi digitali di monitoraggio della qualità migliora la crescita e l'efficienza della produzione di terapie geniche. Nel marzo 2025, Bharat Biotech ha investito 75 milioni di dollari nel suo primo impianto di terapia cellulare e genica nell'India meridionale. Si prevede che nei prossimi 3 anni lancerà nuove terapie per l'oncologia e le malattie rare.
La necessità di strutture specializzate crea un'opportunità sostanziale per le CDMO. Per le aziende biofarmaceutiche, collaborare con le CDMO che dispongono della tecnologia e delle strutture necessarie è economicamente conveniente ed efficiente. Nel 2023, Bristol-Myers Squibb ha collaborato con una CDMO per la produzione della sua terapia cellulare CAR-T, Breyanzi. Questa terapia prevede la raccolta, la modifica e l'espansione delle cellule T di un paziente, un processo che richiede tecnologie e strutture specializzate per garantire l'effetto terapeutico desiderato. Sfruttando l'esperienza delle CDMO in strutture specializzate, Bristol-Myers Squibb è stata in grado di aumentare la produzione garantendo al contempo la conformità normativa e la qualità. Pertanto, si prevede che la crescente necessità di capacità produttive avanzate con tecnologie avanzate creerà future opportunità di crescita per il mercato delle organizzazioni di ricerca e sviluppo a contratto per la terapia cellulare e genica.
Analisi della segmentazione del rapporto di mercato sull'organizzazione di sviluppo e produzione di contratti per la terapia cellulare e genica
I segmenti chiave che hanno contribuito all'analisi del mercato delle organizzazioni di sviluppo e produzione di contratti per la terapia cellulare e genica sono il tipo di servizio, il tipo di prodotto e l'utente finale.
- In base al tipo di servizio, il mercato delle organizzazioni di sviluppo e produzione a contratto per la terapia cellulare e genica è segmentato in sviluppo e produzione di farmaci, servizi di testing e regolamentazione e altri. Il segmento dello sviluppo e della produzione di farmaci deteneva la quota di mercato maggiore nel 2024.
- In termini di tipologia di prodotto, il mercato dello sviluppo e della produzione a contratto di terapia cellulare e genica è suddiviso in terapia genica e terapia cellulare. Il segmento della terapia cellulare ha dominato il mercato nel 2024.
- In base all'utente finale, il mercato delle organizzazioni di sviluppo e produzione a contratto per la terapia cellulare e genica è suddiviso in aziende farmaceutiche, aziende biofarmaceutiche e altre. Il segmento delle aziende biofarmaceutiche ha dominato il mercato nel 2024.
Analisi della quota di mercato per area geografica delle organizzazioni di sviluppo e produzione di contratti per terapia cellulare e genica
L'ambito geografico del rapporto di mercato sullo sviluppo e la produzione di contratti per la terapia genica e cellulare si concentra principalmente su cinque regioni: Nord America, Asia-Pacifico, Europa, America Meridionale e Centrale, Medio Oriente e Africa. In termini di fatturato, il Nord America ha dominato il mercato nel 2024. Si prevede che manterrà la sua posizione dominante nel mercato globale durante il periodo di previsione. Gli Stati Uniti stanno osservando crescenti progressi nel campo delle biotecnologie, una crescente prevalenza di malattie genetiche e una crescente domanda di servizi di produzione specializzati. Secondo le stime del Government Accountability Office degli Stati Uniti pubblicate nell'ottobre 2021, circa 25-30 milioni di persone soffrono di malattie rare nel Paese. Secondo la Food and Drug Administration (FDA), oltre 7.000 malattie rare colpiscono oltre 30 milioni di persone nel Paese. La crescente comprensione di queste malattie ha portato a un'impennata nello sviluppo della terapia genica. Le CDMO svolgono un ruolo cruciale in questo settore fornendo servizi specializzati per lo sviluppo e la produzione di terapie geniche mirate alle malattie genetiche rare.
Nel 2023, la FDA statunitense ha approvato numerose terapie cellulari e geniche, inclusi trattamenti di editing genetico mirati alle malattie rare. Terapie come exagamglogene autotemcel (Casgevy) e lovotibeglogene autotemcel per l'anemia falciforme, così come valoctocogene roxaparvovec per l'emofilia A grave, hanno ricevuto l'approvazione della FDA, evidenziando il potenziale delle terapie geniche nell'affrontare le sfide delle malattie rare. I percorsi normativi accelerati, come la designazione di Terapia Avanzata di Medicina Rigenerativa (RMAT), hanno spinto le aziende biotecnologiche a collaborare con le CDMO per aumentare la produzione.
Gli investimenti nelle infrastrutture produttive hanno sostenuto la crescita del mercato. Il National Cell Manufacturing Consortium, istituito grazie alla collaborazione tra 15 istituti accademici, oltre 25 aziende ed enti governativi, mira a consentire una produzione su larga scala di terapie cellulari a costi contenuti. Anche le collaborazioni strategiche tra CDMO, istituti accademici e aziende biofarmaceutiche contribuiscono alla crescita del mercato.
Approfondimenti regionali sul mercato dell'organizzazione di sviluppo e produzione di contratti per la terapia cellulare e genica
Le tendenze e i fattori regionali che influenzano il mercato delle organizzazioni per lo sviluppo e la produzione di contratti di terapia cellulare e genica durante il periodo di previsione sono stati ampiamente illustrati dagli analisti di Insight Partners. Questa sezione illustra anche i segmenti e l'area geografica del mercato delle organizzazioni per lo sviluppo e la produzione di contratti di terapia cellulare e genica in Nord America, Europa, Asia-Pacifico, Medio Oriente e Africa, e America meridionale e centrale.
- Ottieni i dati specifici regionali per il mercato delle organizzazioni di sviluppo e produzione di contratti di terapia cellulare e genica
Ambito del rapporto di mercato sull'organizzazione di sviluppo e produzione di contratti per la terapia cellulare e genica
| Attributo del report | Dettagli |
|---|---|
| Dimensioni del mercato nel 2024 | 6,22 miliardi di dollari USA |
| Dimensioni del mercato entro il 2031 | 31,86 miliardi di dollari USA |
| CAGR globale (2025-2031) | 26,4% |
| Dati storici | 2021-2023 |
| Periodo di previsione | 2025-2031 |
| Segmenti coperti |
Per tipo di servizio
|
| Regioni e paesi coperti |
America del Nord
|
| Leader di mercato e profili aziendali chiave |
|
Sviluppo contrattuale e organizzazione di produzione di terapie cellulari e geniche: densità degli attori del mercato: comprendere il suo impatto sulle dinamiche aziendali
Il mercato delle organizzazioni di sviluppo e produzione a contratto per la terapia cellulare e genica è in rapida crescita, trainato dalla crescente domanda degli utenti finali, dovuta a fattori quali l'evoluzione delle preferenze dei consumatori, i progressi tecnologici e una maggiore consapevolezza dei benefici del prodotto. Con l'aumento della domanda, le aziende stanno ampliando la propria offerta, innovando per soddisfare le esigenze dei consumatori e capitalizzando sulle tendenze emergenti, alimentando ulteriormente la crescita del mercato.
La densità degli operatori di mercato si riferisce alla distribuzione delle imprese che operano in un determinato mercato o settore. Indica quanti concorrenti (operatori di mercato) sono presenti in un determinato spazio di mercato in relazione alle sue dimensioni o al suo valore totale.
Le principali aziende che operano nel mercato dello sviluppo e della produzione su contratto di terapia cellulare e genica sono:
- WuXi Biologics Inc
- Charles River Laboratories International Inc
- Catalent Inc
- Lonza Group AG
- Thermo Fisher Scientific Inc.
- AGC Biologics AS
Disclaimer : le aziende elencate sopra non sono classificate secondo alcun ordine particolare.
- Ottieni una panoramica dei principali attori del mercato dell'organizzazione di sviluppo e produzione di contratti per la terapia cellulare e genica
Organizzazione per lo sviluppo e la produzione di contratti di terapia cellulare e genica - Notizie di mercato e sviluppi recenti
Il mercato delle organizzazioni di sviluppo e produzione a contratto per la terapia cellulare e genica viene valutato raccogliendo dati qualitativi e quantitativi post-ricerca primaria e secondaria, che includono importanti pubblicazioni aziendali, dati di associazioni e database. Di seguito sono riportati i principali sviluppi osservati nel mercato delle organizzazioni di sviluppo e produzione a contratto per la terapia cellulare e genica:
- WuXi Biologics lancia la piattaforma di espressione microbica EffiX per potenziare la produzione di proteine ricombinanti e DNA plasmidico. (Fonte: WuXi Biologics, marzo 2025)
- Charles River Laboratories International, Inc. e AAVantgarde hanno annunciato un accordo CDMO per la produzione di DNA plasmidico conforme alle Norme di Buona Fabbricazione (GMP). AAVantgarde, un'azienda biotecnologica in fase clinica con due piattaforme proprietarie di vettori virali adeno-associati (AAV) per la somministrazione genica su larga scala e lo sviluppo di prodotti per il trattamento di patologie retiniche ereditarie, sfrutterà l'esperienza di Charles River nella produzione di DNA plasmidico conforme alle Norme di Buona Fabbricazione (GMP). (Fonte: Charles River Laboratories International, Inc., luglio 2024)
- Siren Biotechnology, pioniera della terapia immunogenica universale AAV per il cancro, ha stretto una partnership strategica con Catalent Inc., leader nello sviluppo e nella fornitura di trattamenti migliori per i pazienti di tutto il mondo, per supportare lo sviluppo e la produzione delle terapie immunogeniche AAV di Siren Biotechnology. (Fonte: Catalent Inc., comunicato stampa, maggio 2024)
Copertura e risultati del rapporto di mercato sull'organizzazione di sviluppo e produzione di contratti per la terapia cellulare e genica
Il rapporto "Dimensioni e previsioni del mercato delle organizzazioni per lo sviluppo e la produzione di contratti di terapia cellulare e genica (2021-2031)" fornisce un'analisi dettagliata del mercato che copre le seguenti aree:
- Dimensioni e previsioni del mercato dei dispositivi di chiusura delle ferite a livello globale, regionale e nazionale per tutti i principali segmenti di mercato coperti dall'ambito
- Tendenze del mercato dei dispositivi di chiusura delle ferite, nonché dinamiche di mercato quali driver, sistemi di ritenuta e opportunità chiave
- Analisi PEST e SWOT dettagliate
- Analisi di mercato dei dispositivi di chiusura delle ferite che copre le principali tendenze del mercato, il quadro globale e regionale, i principali attori, le normative e i recenti sviluppi del mercato
- Analisi del panorama industriale e della concorrenza che copre la concentrazione del mercato, l'analisi della mappa di calore, i principali attori e gli sviluppi recenti per il mercato dell'organizzazione di sviluppo e produzione di contratti di terapia cellulare e genica.
- Profili aziendali dettagliati
- Analisi storica (2 anni), anno base, previsione (7 anni) con CAGR
- Analisi PEST e SWOT
- Valore/volume delle dimensioni del mercato - Globale, Regionale, Nazionale
- Industria e panorama competitivo
- Set di dati Excel
Report recenti
Testimonianze
Motivo dell'acquisto
- Processo decisionale informato
- Comprensione delle dinamiche di mercato
- Analisi competitiva
- Analisi dei clienti
- Previsioni di mercato
- Mitigazione del rischio
- Pianificazione strategica
- Giustificazione degli investimenti
- Identificazione dei mercati emergenti
- Miglioramento delle strategie di marketing
- Aumento dell'efficienza operativa
- Allineamento alle tendenze normative





















 Ottieni un campione gratuito per - Mercato delle organizzazioni di sviluppo e produzione di contratti per la terapia cellulare e genica
Ottieni un campione gratuito per - Mercato delle organizzazioni di sviluppo e produzione di contratti per la terapia cellulare e genica